三苯甲基自由基
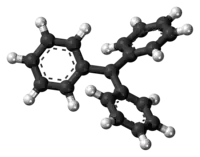
三苯甲基自由基(化学式:(C6H5)3C·)是有机化学家所观测到的第一个自由基。由于苯基体积较大,三苯甲基自由基中的三个苯基不可能与中间的碳原子共平面,而是排成螺旋桨式。由于三个苯基的存在形成离域体系,故三苯甲基自由基比一般的自由基都要稳定得多。
| 三苯甲基自由基 | |
|---|---|
 | |
 | |
| 识别 | |
| CAS号 | |
| ChemSpider | 10627185 |
| SMILES |
|
| 性质 | |
| 化学式 | C19H15 |
| 摩尔质量 | 243.32 g·mol−1 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
历史
1900年,摩西·冈伯格(Moses Gomberg)用纯银或锌在苯等惰性溶剂中处理三苯卤甲烷得到一个白色固体。[1][2][3]
冈伯格认为该白色固体是三苯卤甲烷的 Wurtz反应偶联产物六苯乙烷(下图中的 4)。但他随即发现这个产物比他想象中的六苯乙烷要活泼许多,例如它可以很快与碘和氧气发生作用,分别生成三苯碘甲烷和过氧化物。
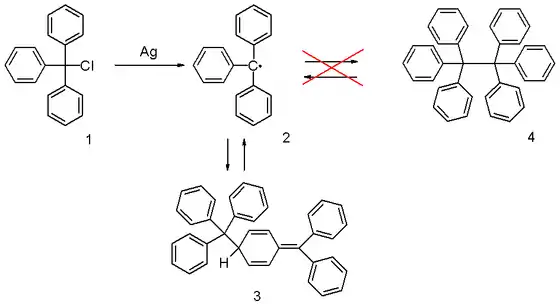
固体是三苯甲基自由基 (2)发生二聚生成的六苯乙烷 (4)。
“六苯乙烷”在溶液中部分离解为自由基,例如它的苯和醚溶液呈黄色,若迅速振荡,则由于和空气接触发生氧化而颜色消失,过几秒钟后黄颜色重现,继续振荡时黄颜色又消失,这样消失又出现反复多次。这是最早报道自由基存在的一个现象,尽管当时关于自由基的说明还不能为许多化学家所接受。
从上述溶液还可以分离出三苯甲基的过氧化物,白色固体,熔点 185°C。从此可以得出一个结论,即“六苯乙烷”在溶液中仅部分离解为有色的自由基,并且为可逆过程。而当溶液中的自由基遇到氧气,则形成无色的过氧化物。有多少“六苯乙烷”分解为自由基,则形成相应量的过氧化物,而当这个溶液放置时,根据勒沙特列原理,“六苯乙烷”又部分离解为自由基,并达到平衡,颜色又出现。
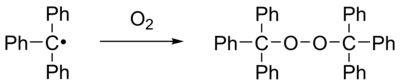
当将“六苯乙烷”的溶液冷却至 −196°C 时,则黄颜色消失,并且在此温度下不能与氧作用。它的1%苯溶液在 20°C 仅有 2~3%发生离解,但在 80°C 时则有 25~30%发生离解。[4]
“六苯乙烷”离解为自由基的程度也决定于芳基的性质和浓度,一般随价电子云分散的可能性增大而增加。
1904年时有人提出“六苯乙烷”的结构实际上为醌式结构(图1中的 3),但这个说法不为当时的大多数化学家所接受,长期来人们还是一直认为存在如下平衡:[5]
直到 1968 年,有人利用核磁共振谱和紫外光谱研究上述平衡体系,发现所谓“六苯乙烷”确为醌式结构。[6] 两个三苯甲基自由基并非简单的甲基碳之间的偶联,二聚的方式为一个三苯甲基碳加到另一个自由基中苯基的对位上,形成一个环己二烯衍生物。从三苯甲基自由基的构型很容易看出,两个巨大的自由基很难彼此接近而形成六苯乙烷,而是以较小空间要求的方式形成醌式二聚体。
参考资料
- M. Gomberg. . J. Am. Chem. Soc. 1900, 22 (11): 757–771. doi:10.1021/ja02049a006.
- M. Gomberg. . J. Am. Chem. Soc. 1901, 23 (7): 496–502. doi:10.1021/ja02033a015.
- M. Gomberg. . J. Am. Chem. Soc. 1902, 24 (7): 597–628. doi:10.1021/ja02021a001.
- Advanced Organic Chemistry J. March, John Wiley & Sons ISBN 0-471-88841-9
- J. M. McBride. . Tetrahedron. 1974, 30 (14): 2009–2022. doi:10.1016/S0040-4020(01)97332-6.
- H. Lankamp, W. Th. Nauta and C. MacLean. . Tetrahedron Letters. 1968, 9 (2): 249–254. doi:10.1016/S0040-4039(00)75598-5.