四甲基铵盐
四甲基铵阳离子,简称TMA或Me4N+是最简单的季铵阳离子,由四个甲基和中心的氮阳离子组成,和新戊烷是等电子体。它有正电荷,只能在平衡离子存在下才能分离。四甲基铵盐则是这种离子形成的化合物,例如四甲基氯化铵和四甲基氢氧化铵。四甲基铵盐可用于化学合成,并广泛用于药理学研究。
| 四甲基铵阳离子 | |||
|---|---|---|---|
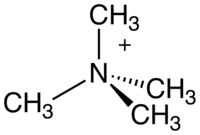 | |||
| |||
| IUPAC名 N,N,N-Trimethylmethanaminium[1] | |||
| 别名 | Tetramethylammonium[1] Tetramethylazanium Tetramine | ||
| 识别 | |||
| CAS号 | 51-92-3 | ||
| PubChem | 6380 | ||
| ChemSpider | 6140 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QEMXHQIAXOOASZ-UHFFFAOYSA-N | ||
| ChEBI | 46020 | ||
| 性质 | |||
| 化学式 | C4H12N+ | ||
| 74.14 g·mol⁻¹ | |||
| 危险性[2][3](四甲基氯化铵的数据) | |||
| 致死量或浓度: | |||
LD50(中位剂量) |
25 mg/kg(小鼠,腹腔注射) 40 mg/kg(小鼠,皮下注射) | ||
LC50(中位浓度) |
462 mg/L (96 小时,Pimephales promelas) | ||
| 相关物质 | |||
| 相关等电子体 | 新戊烷 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
制备、反应、溶液性质
.png.webp)
- Me3N + Me−I → Me4N+I−
有14C 标记的四甲基铵盐可以通过这种方法制备。[7]
尽管这个反应对简单的卤化物是合适的,不过有更复杂的阴离子的四甲基铵盐需要使用复分解反应制备。举个例子,四甲基硼氢化铵可以从四甲基氢氧化铵制备:[8]
- Me4N+[OH]− + Na+[BH4]− → Me4N+[BH4]− + Na+ + HO−
类似其它季铵盐,四甲基铵盐是一种相转移催化剂,但由于其高亲水性而表现得异常。[9]
在四甲基铵阳离子中,四个甲基以四面体排列在中心氮原子的周围,这从其盐的X射线晶体学研究中就可以明显看出。[11][12]根据对分子模型的测量,估计四甲基铵阳离子的直径约为 0.6 nm,[13]更准确的物理化学测量显示四甲基铵阳离子的离子半径为 0.322 nm,也记录了这种离子的几个热力学参数。[14][15]
毒性
四甲基铵盐的人类毒理学研究主要是在摄入香螺属后意外中毒的情况下进行的。[4]四甲基铵盐中毒症状包括恶心、呕吐、头痛、眩晕/头晕、视力受损/暂时失明、复视、畏光、缺乏平衡、有中毒感和荨麻疹。这些症状会在 30 分钟内出现,但通常会在几个小时后完全恢复。只有一个人在摄入来自Courbonia virgata的四甲基铵盐后死亡的记录。[6]虽然这些症状中大多可以根据自主神经系统中的神经传递受损来解释,但似乎也有明显的中枢影响迹象。[4]
在动物研究中,将含有四甲基铵盐的香螺属提取物对小鼠、猫和鱼进行肠胃外给药,主要表现出涉及骨骼肌的影响:肌肉震颤、抽搐、失去平衡、运动麻痹,最终呼吸停止。[4]
四甲基铵盐对人类的致死量估计为 3–4 mg/kg(口服),[4][6]对大鼠的致死量则估计为 ~45–50 mg/kg(口服)和 ~15 mg/kg(腹腔注射)[16]
参见
参考资料
- . Cambridge: The Royal Society of Chemistry. 2014: 1086. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- R. J. Lewis (Ed.) (2004), Sax's Dangerous Properties of Industrial Materials, 11th Ed. p. 3409, Wiley-Interscience, Wiley & Sons, Inc., Hoboken, NJ.
- http://toxnet.nlm.nih.gov/cgi-bin/sis/search/a?dbs+hsdb:@term+@DOCNO+7987
- Anthoni, U.; Bohlin, L.; Larsen, C.; Nielsen, P.; Nielsen, N. H.; Christophersen, C. . Toxicon. 1989, 27: 707–716. doi:10.1016/0041-0101(89)90037-8.
- Dolan, L. C.; Matulka, R. A.; Burdock, G. A. . Toxins (Basel). 2010, 2: 2289–2332. PMC 3153292
 . PMID 22069686. doi:10.3390/toxins2092289.
. PMID 22069686. doi:10.3390/toxins2092289. - Henry, A. J. . Br. J. Pharmacol. Chemother. 1948, 3: 187–188. PMC 1509833
 . PMID 18883998. doi:10.1111/j.1476-5381.1948.tb00373.x.
. PMID 18883998. doi:10.1111/j.1476-5381.1948.tb00373.x. - Tsubaki, H.; Nakajima, E.; Komai, T.; Shindo, H. . J. Pharmacobio-Dyn. 1986, 9: 737–746. doi:10.1248/bpb1978.9.737
 .
. - Banus, M. D.; Bragdon, R. W.; Gibb, T. R. P. . J. Am. Chem. Soc. 1952, 74: 2346–2348. doi:10.1021/ja01129a048.
- Fedorynski, M.; Ziolkowska, W.; Jonczyk, A. . J. Org. Chem. 1993, 58: 6120–6121. doi:10.1021/jo00074a047.
- Koga, Y.; Westh, P.; Nishikawa, K.; Subramanian, S. . J. Phys. Chem. B. 2011, 115: 2995–3002. doi:10.1021/jp108347b.
- McLean, W. J.; Jeffrey, G. A. . J. Chem. Phys. 1967, 47: 414–417. doi:10.1063/1.1711910.
- McCullough, J. D. . Acta Crystallogr. 1964, 17: 1067–1070. doi:10.1107/s0365110x64002687
 .
. - McCleskey, E. W.; Almers, W. . Proc. Natl. Acad. Sci. USA. 1985, 82: 7149–7153. PMC 391328
 . PMID 2413461. doi:10.1073/pnas.82.20.7149.
. PMID 2413461. doi:10.1073/pnas.82.20.7149. - Aue, D. H.; Webb, H. M.; Bowers, M. T. . J. Am. Chem. Soc. 1976, 98: 318–329. doi:10.1021/ja00418a002.
- Palomo, J.; Pintauro, P. N. . J. Membrane Sci. 2003, 215: 103–114. doi:10.1016/s0376-7388(02)00606-3.
- Anthoni, U.; Bohlin, L.; Larsen, C.; Nielsen, P.; Nielsen, N. H.; Christophersen, C. . Toxicon. 1989, 27: 717–723. doi:10.1016/0041-0101(89)90038-x.