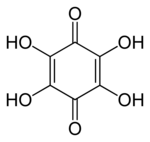
四羟基对苯醌
四羟基对苯醌,又称四羟基-1,4-苯醌 (THBQ, THQ),是一种有机化合物,化学式 C
6O
2(OH)
4。它是对苯醌的四个氢原子都被羟基取代而成的化合物。
| 四羟基对苯醌[1] | |
|---|---|
 | |
 | |
| IUPAC名 2,3,5,6-Tetrahydroxycyclohexa-2,5-diene-1,4-dione | |
| 别名 | 四羟基-1,4-苯醌 |
| 识别 | |
| CAS号 | 319-89-1 |
| PubChem | 5424 |
| ChemSpider | 5231 |
| SMILES |
|
| InChI |
|
| InChIKey | DGQOCLATAPFASR-UHFFFAOYSA-N |
| EINECS | 206-275-5 |
| ChEBI | 137472 |
| 性质 | |
| 化学式 | C6H4O6 |
| 摩尔质量 | 172.09 g·mol−1 |
| 外观 | 蓝黑色晶体 |
| 密度 | 2.609 g/cm3 |
| 沸点 | 370.6 °C(644 K)(当760 mmHg) |
| 溶解性(水) | 微溶 |
| 危险性 | |
GHS危险性符号 | |
| GHS提示词 | Warning |
| H-术语 | H315, H319, H335 |
| P-术语 | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
它的水溶液是浅红色的,[2]并结晶为闪闪发光的蓝黑色(但不导电)的二水合物 C
6O
2(OH)
4 · 2H2O。[2][3]
四羟基对苯醌的盐
类似大部分的酚,四羟基对苯醌是酸性的,很容易离解出氢离子,产生像是 C
6H
2O2−
6 和C
6O4−
6的阴离子。后者是对称的有芳香性。
它的钙盐 Ca
2C
6O
6是Chromohalobacter beijerinckii在盐豆发酵过程中从肌醇中产生的深紫色色素,在1935年已经被T. Hof注意到。[3][7][8][9][10]
深紫色,不溶的二钾盐 K
2C
6H
2O
6 是由Paul W. Preisler和Louis Berger于 1942年首次合成,它们通过肌醇与硝酸在氧气存在下与碳酸钾反应,得到这种化合物。这种盐和盐酸的反应可以得到高产率的四羟基对苯醌。[11]
黑色的四钾盐 K
4C
6O
6 是由Robert West和Hsien Ying Niu在1962年通过在甲醇中反应四羟基对苯醌和甲醇钾,首次合成这种化合物。这种盐是抗磁性的,红外光谱表明 C-C 和 C-O 距离相等,环在环己烷构象中略微扭曲。[12]K
4C
6O
6 的部分氧化会产生绿色,很顺磁性的固体,可能是 3K+
· C
6O3−
6,完全氧化则会产生二羟基环己烯四酮二钾 2K+
· C
6O2−
6。[12]
绿黑色的钠盐 Na
4C
6O
6 在1962年由Alexander J. Fatiadi和W. F. Sanger描述。[4]
深紫色的锂盐 Li
4C
6O
6已被提议作为电池的电极材料,因为它可以被氧化成二羟基环己烯四酮盐 Li
2C
6O
6或还原成苯六酚盐 Li
6C
6O
6。[5]在没有氧气的情况下,Li
4C
6O
6在450 °C 下稳定,然后分解成碳酸锂。[5]二羟基环己烯四酮盐在400 °C 下会歧化成Li
4C
6O
6 和环己六酮 C
6O
6,后者会迅速分解成一氧化碳、二氧化碳和碳。[5]Li
4C
6O
6 的水合物 Li
4C
6O
6 · 2H2O在 250 °C下失水。[5]
参考资料
- 11th. : 9177.
|entry=被忽略 (帮助) - Klug, H. P. . Acta Crystallographica. 1965, 19 (6): 983. doi:10.1107/S0365110X65004760.
- Miller, M. W. . McGraw-Hill. 1961.
- (1962) "Tetrahydroxyquinone". Org. Synth. 42; Coll. Vol. 5: 1011.
- Chen, H.; Armand, M.; Courty, M.; Jiang, M.; Grey, C. P.; Dolhem, F.; Tarascon, J.-M.; Poizot, P. . Journal of the American Chemical Society. 2009, 131 (25): 8984–8988. PMID 19476355. doi:10.1021/ja9024897.
- Cowan, J. A.; Howard, J. A. K.; Leech, M. A. . Acta Crystallographica Section C. 2001, 57 (10): 1196–1198. PMID 11600783. doi:10.1107/S0108270101011647.
- Hof, T. . Recueil des travaux botaniques néerlandais. 1935, 32: 92.
- Kluyver, A. J.; Hof, T.; Boezaardt, A. G. J. . 1939.
- 3. 1945.
- Underkofler, L. A.; Hickey, R. J. . 1954.
- Preisler, P. W.; Berger, L. . Journal of the American Chemical Society. 1942, 64 (1): 67–69. doi:10.1021/ja01253a016.
- West, R.; Niu, H. Y. . Journal of the American Chemical Society. 1962, 84 (7): 1324–1325. doi:10.1021/ja00866a068.