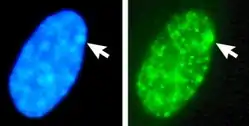
巴爾小體
巴爾小體(英語:),也譯作巴氏小體或巴爾氏體,得名自其發現者穆雷·巴爾[1],是哺乳动物(包括人类)在具有多于一个X染色體的細胞中,其中一條去活化的X染色體[2]。X染色體去活化機制由一種名為Xist的长链非编码RNA控制,此RNA介導多種DNA與組蛋白的修飾,抑制基因表現,使其成為異染色質,即巴爾氏體。
巴爾氏體上除了偽體染色體區的基因仍可表現外,其餘片段的基因都受到抑制,這種現象稱為基因靜默。巴爾氏體產生的目的和避免雌性的X染色體劑量過多有關,造成雌性身體由關閉不同X染色體的兩群不同的細胞組成,稱為鑲嵌體(),可以產生兩種不同的表現型,這也是三色貓有三種毛色的原因。
發現過程

1948年加拿大生物學家穆雷·巴爾和研究生尤爾特·伯特倫研究有關疲勞對大腦的影響,觀察貓腦組織,以福爾根試劑將細胞核內的DNA染色。在观察一些母猫神经元時,他意外发现在核膜内缘有一小團染色極深的鼓槌狀物質(公貓則沒有這樣的現象),由於神經元細胞當時不是處在細胞分裂狀態,DNA應是散落成染色質,而非結成團狀構造。巴爾在觀察了其他動物的相關玻片標本後,歸納出一個結論:這些DNA團塊是存在雌性哺乳類細胞內的明顯差異[3]:179。
次年,巴爾與伯特倫聯合出版了一篇論文[4],發表他所發現的奇異現象,當時他將發現的小團鼓槌狀物質稱為「性染色質」(Sex chromatin),也就是後人所謂的「巴爾氏體」。
1955年,巴爾和解剖學家穆爾(K. L. Moore)觀察口腔黏膜发现,女性口腔上皮细胞核膜内缘有同样的小体紧贴在核膜上,而男性却没有[5]。这进一步证明了这个染色较深的小体和性别有关。人们把这个染色较深的小体称为性染色质,又称巴氏小体。
1960年,美國洛杉磯希望之城癌症研究中心的科學家大野乾經過徹底研究母鼠的X染色體後宣布,巴爾氏體其實就是X染色體,隔年英國遺傳學家瑪莉·里昂發表論文,以精簡的文字將當時已知的各種現象串連起來,解釋巴爾氏體的存在,及它如何以前所未知的方式對哺乳動物造成影響[3]:181。
里昂假說
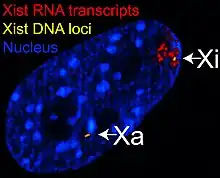
瑪莉·里昂提出,雄鼠和基因型為「XO」的異常雌鼠只有一條X染色體,細胞就能正常運作,因此正常雌鼠也應該只需要一條X染色體就能運作,不用兩個活化的X染色體。其次,巴爾氏體在很早期的胚胎階段就已出現。最後,里昂提出她所觀察到小鼠毛色的特殊模式:已知控制毛色的基因位於X染色體,毛色的表現依循性聯遺傳,異型合子的雌鼠會出現特有的斑駁毛色,也就是由兩種顏色的毛皮組成,隨機分布而成斑塊狀[3]:182。
里昂解釋,雌鼠胚胎發育時,細胞會隨機關閉一條X染色體,並將其聚縮成巴爾氏體(這條染色體被稱為Xi),從此之後,由這些細胞複製、分化來的子細胞,遺傳到的兩條X染色體中,都有一條是不活化的巴爾氏體,只由另一條正常的X染色體(這條染色體被稱為Xa)表現基因,影響細胞運作。結果,雌鼠體內就會含有兩大群不同的細胞,用不同條X染色體影響各種性狀,因為兩個X染色體中哪一個將形成巴爾氏體的選擇是随機和獨立地發生在胚胎的每一個細胞,包括人在內的雌性哺乳動物其實是兩種細胞的鑲嵌體(mosaic)[6]。
結構與機制
巴爾氏體依附在細胞核邊緣的核膜內側,雖然此染色體上的小部份區域能保持著活躍的狀態,但大多數的基因都是不會表現的。X染色體去活化發生後,形成巴爾氏體的那條X染色體通常稱為Xi,其大部分基因將不會被表現;另一條基因能得到充分表現的X染色體則稱為Xa。X染色體失活由一種名為Xist的长链非编码RNA介導,從「X失活中心」(Xic)開始向兩側擴張。
失活過程
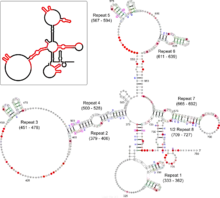
失活的X染色體(Xi)由其上的某個點開始往兩頭產生皺縮,直到染色體的末端,這個開始產生皺縮的點被稱為「X失活中心」(英語:, Xic),X失活中心共含有12個基因,其中7個編碼蛋白質,另外5個則編碼Xist(,意為失活X染色體特定轉錄)和Tsix(Xist的反義序列)等长链非编码RNA[8]。Xist是執行X染色體去活化的基因,其轉錄出的RNA會把Xi包圍,介導修飾染色體的酵素與其結合,以進行組蛋白甲基化(例如由多梳家族蛋白(PRC2)造成的H3K27me3[9]、H3K9me3[10])、組蛋白泛素化[11]、CpG位點的DNA甲基化[12]等修飾,達到基因靜默的效果,最終使Xi皺縮成巴爾氏體,其上多數基因都無法表达[3]:187[13]。Tsix基因是Xist的反義序列,是Xist的負向調節因子[14],可與Xist結合後,使其被Dicer降解[15]。在X染色體去活化發生之前,兩個X染色體均會表达Xist和Tsix,當去活化開始時,Xi將停止表达Tsix,使Xist的表达量增加;Xa則保持Tsix的表达,使Xist的表达量維持在較低水平[16]。另外相較於Xa,Xi染色體中組蛋白乙醯化與組蛋白H3K4me3等促進基因表达的修飾程度均較低[10],且Xi染色體中有一種稱為mH2A1的特有組蛋白H2A亞型[17]。
研究人員分析Xist的結構,將其分成數個區域,也已證明了特定區域與計算X染色體數量有關,其中有區域與該選擇哪一條X染色體作為Xi有關,有區域與失活的過程有關[3]:188,有一段被稱為「A區域」(A region)的片段由兩段長長的莖環組成,每段莖環上有四個重複序列,已知與蛋白質的結合有關[18]。另外Xist還有一段序列被稱為「C區域」(C region),為與染色體結合的區域[19]。
無論細胞中有幾個X染色體(即包括XXY、X0與XX雜合體、XXXY等特殊情況),除了一個X成為Xa之外,其他X染色體上的Xist基因都能正確啟動。且Xist不只能作用於X染色體,若將Xist剪接到其他體染色體上,該條染色體也會失去活性[3]:188。而關於生物如何避免讓兩段X染色體都失活,目前的假說認為體染色體上有某個基因可以製造「阻礙因子」(blocking factor),阻礙因子可與X染色體結合,避免其被去活化,而其他未結合阻礙因子的X染色體則不受保護[20]。
失活的時期
發生X染色體去活化的時間很早,在二細胞至四細胞時期就已發生,其中外細胞團的細胞(extraembryonic tissue,未來將成為胎盤)中的Xi將繼續保持失活狀態;內細胞團的細胞(inner cell mass,未來將成為胚胎)中的Xi則會復原,之後再失去活性。以老鼠為例,其第一次X染色體去活化受基因銘印影響,全部使父系X染色體成為Xi,母系X染色體成為Xa,第二次去活化則是隨機選擇。這種機制使胎盤的X染色體全為母系,可能可以避免其受母體細胞排斥(但由於控制排斥的基因多不在X染色體上,關閉胎盤的父系X染色體可能無法避免移植排斥,目前這種說法未有定論)[22][3]:193。
演化意義
正常男性只有一條X染色體,女性卻有兩條,使兩者X染色體的劑量不一致,早在1930年代,生物學家就已發現這種染色體含量不均等的問題,並疑惑為何女性不會因為X染色體劑量過多而發生問題[3]:184,里昂的理論則可解釋這個問題,為了避免基因過量,女性胚胎會隨機讓每個細胞的一條X染色體失去活性,變成巴爾氏體,所以女性的每個細胞都只有一個有作用的X染色體,不會產生過量的問題[3]:185。其他動物可能有別的方法避免X染色體劑量不均等,例如線蟲不會進行X染色體去活化,而是把雌性兩條X染色體的活性都減半[3]:185;果蠅則是雌蠅的兩條X染色體都有正常作用,但雄蠅的單一X染色體會發揮兩倍的活性[3]:186。
另外,由於不同於體染色體,無論男性或女性都只有一條有用的X染色體,所以X染色體上的基因的活性都需要加倍,以達到正常需求。在演化的過程中,基因有時會移位至別的染色體,但鮮少從體染色體移至X染色體,或從X染色體移至體染色體,因為活性的差異,體染色體的基因若到了X染色體,則其活性只有周圍基因的一半;而X染色體的基因若到了體染色體,活性將會是周圍基因的兩倍,可能是活性導致體染色體和X染色體間產生演化的阻隔,[3]:195。
例外情形
雖然雌性哺乳類身上的細胞幾乎都有X染色體去活化的機制,但仍有一些例外情形。
卵子
女性的卵子細胞會將Xist基因關閉,使已經形成的巴爾氏體再次展開,轉變回原始的狀態。這種機制的目的是母體不能把巴爾氏體傳給子代,因為卵子無從得知子代將形成男性或女性,若子代是男性,又遗传到巴爾氏體,就會危及男孩的性命,所以每個女性必須重新啟動失活過程。
但由於帶有兩個功能齊全的X染色體將造成劑量過多的問題,而卵子在形成後將在女性體內存活四十年以上,在這段期間內,卵子如何避免X染色體劑量過多造成的危險情況,目前仍是個謎[3]:190。
影響
巴爾氏體的產生造成女性成為鑲嵌體,對女性的許多疾病和基因表現都有顯著的影響。許多費解的現象都能由巴爾氏體獲得解釋,但部分理論仍不完整,仍需進一步的證據。
同卵雙胞胎
同卵雙胞胎姊妹間雖然基因大致相同,卻可能因為X染色體去活化而產生差異,如果一個女性身上的細胞剛好使用較多的母系X染色體,而她的雙胞胎姊妹則偏好使用較多的父系X染色體,則她們的性狀(甚至包括罹患遺傳疾病與否)都會有所差異。由於女性有約5%的基因存在X染色體上,因此高達5%的基因可能造成同卵雙胞胎姊妹的差異(另外無論性別,受精卵分裂成兩個個體後,還會發生一些微小變化,亦可造成同卵雙胞胎之間的差異)[3]:198。
同卵雙胞胎姊妹常偏好使用不同的X染色體,關於此現象的解釋有個頗具爭議的理論,即女性胚胎細胞在選定失活的X染色體後,會主動將自己分為兩大群採用不同Xa的細胞,這兩群細胞可能主動排斥而造成胚胎分裂,形成雙胞胎。這個理論雖仍有不足之處,例如不能解釋同卵雙胞胎兄弟的形成,但已經引起相當的討論[3]:206[25]。
性聯遺傳疾病
女性若只有一個帶有性聯疾病基因的X染色體,並不會發病,因為另一個X染色體上正常的基因可彌補此缺陷。以血友病為例,致病原因是第八凝血因子缺乏,而第八凝血因子是由肝臟製造,控制其生產的基因位在X染色體上,男性因為只有一個X染色體,若基因受損,肝臟即完全無法製造第八因子而致病;而女性若有一個X染色體帶有受損基因,則在X染色體去活化的結果下,將有一部分的肝臟細胞有製造第八因子的能力,另一部分則沒有,而有製造第八因子能力的那一部分肝臟細胞即足以維持身體的機能,因此有一個X染色體基因受損的女性不會得到血友病[3]:201。
上述是不同細胞可替代彼此功能的例子,但對於無汗症患者而言,該病將導致皮膚缺乏汗腺,因此帶有一個缺陷基因的女性將會有一部分皮膚有汗腺,另一部分沒有,形成顯著的「鑲嵌模式」[3]:202。
自體免疫疾病
自體免疫疾病的女性患者多於男性患者,且XXY的男性明顯多於正常男性,對此有人主張造成自體免疫的疾病可能和巴爾氏體有關。機制是若胸腺中的細胞在X染色體去活化後偏向使用某一個X染色體,可能導致產生的部分淋巴球只認得活化的X染色體和胸腺細胞相同的細胞,而誤把失活方向為另一個X染色體的細胞當成外來物質,加以攻擊[3]:210[26]。
女性和XXY的男性均有巴爾氏體,而自體免疫疾病的女性患者高達男性的四倍,且XXY的男性比正常男性容易得到自體免疫疾病,以及某些女性的自體免疫疾病呈現鑲嵌模式等證據支持這個理論,且已有實驗證明兩種自體免疫疾病:類風濕性關節炎及橋本氏甲狀腺炎的產生均和X染色體去活化有關[27]。但仍有其他理論解釋自體免疫疾病的成因,如激素的影響或胎兒細胞的殘留[3]:210。
應用
自1968年墨西哥奧運會起,奧運首次開始檢測女性運動員的性別,以有巴爾氏體與否作為判斷女性的辨識標準,這是區分人類性別的一種簡單方式[3]:180。1992年巴塞隆納夏季奧運會之後,國際奧委會改以用聚合酶鏈鎖反應(PCR)的方法檢測Y染色體上的SRY基因。1999年後國際奧委會停止進行性別檢測,而只對特定有爭議的運動員進行個別檢測,其中原因包括其衍伸的性別歧視問題(因為只有女性需要做性別檢測),以及生物性別不一定等於基因性別等,即應以運動員體內雄性激素表現量來判定他屬於男性或女性的體能,而非染色體[28]。2008年的北京奧運,奧運會首次成立「性別鑒定實驗中心」,被懷疑性別的女運動員將到此接受篩檢,檢測項目包括臨床、性激素、基因、染色體等[29][30]。
比起刻意隱瞞性別者,比較多的情況是性別處於模糊地帶或自己不清楚自己的性別,例如其中有的是睪丸女性化症候群,該疾病會讓XY的男性發育成女性的外表[31]。
參考文獻
- Barr, M. L.; Bertram, E. G. . Nature. 1949, 163 (4148): 676–7. Bibcode:1949Natur.163..676B. PMID 18120749. S2CID 4093883. doi:10.1038/163676a0.
- Lyon, M. F. . Seminars in Cell & Developmental Biology. 2003, 14 (6): 313–318. PMID 15015738. doi:10.1016/j.semcdb.2003.09.015.
- 班布里基著, 陳雅茜 譯. . 天下文化出版社. 2004年10月. ISBN 986-417-380-4.
- Murray L. Barr and Ewart G. Bertram. . Nature. 1949, 163: 676–677. PMID 18120749. doi:10.1038/163676a0.
- W.J. BRADY. . the canadian encyclopedia.
- Oakes, Elizabeth H. Lyon, Mary Frances. International Encyclopedia of Women Scientists. New York, NY. Facts On File, Inc. 2002. Facts On File, Inc. Science Online.
- Fang R, Moss WN, Rutenberg-Schoenberg M, Simon MD. . PLoS Genetics. December 2015, 11 (12): e1005668. PMC 4672913
 . PMID 26646615. doi:10.1371/journal.pgen.1005668.
. PMID 26646615. doi:10.1371/journal.pgen.1005668. - Rougeulle, Claire; Avner, Philip. . Seminars in Cell & Developmental Biology. 2003, 14 (6): 331–340. ISSN 1084-9521. doi:10.1016/j.semcdb.2003.09.014.
- Heard, Edith; Rougeulle, Claire; Arnaud, Danielle; Avner, Philip; Allis, C.David; Spector, David L. . Cell. 2001, 107 (6): 727–738. ISSN 0092-8674. doi:10.1016/S0092-8674(01)00598-0.
- Ng, Karen; Pullirsch, Dieter; Leeb, Martin; Wutz, Anton. . EMBO reports. 2007, 8 (1): 34–39. ISSN 1469-221X. doi:10.1038/sj.embor.7400871.
- de Napoles, Mariana; Mermoud, Jacqueline E.; Wakao, Rika; Tang, Y.Amy; Endoh, Mitusuhiro; Appanah, Ruth; Nesterova, Tatyana B.; Silva, Jose; Otte, Arie P.; Vidal, Miguel; Koseki, Haruhiko; Brockdorff, Neil. . Developmental Cell. 2004, 7 (5): 663–676. ISSN 1534-5807. doi:10.1016/j.devcel.2004.10.005.
- Chadwick, Brian P; Willard, Huntington F. . Seminars in Cell & Developmental Biology. 2003, 14 (6): 359–367. ISSN 1084-9521. doi:10.1016/j.semcdb.2003.09.016.
- . NCBI. 2010-11-04.
- Mlynarczyk SK, and Panning B. . Current Biology. December 2000, 10 (24): R899-903. PMID 11137025 (英语).
- Ogawa, Y.; Sun, B. K.; Lee, J. T. . Science. 2008, 320 (5881): 1336–1341. ISSN 0036-8075. doi:10.1126/science.1157676.
- Lee, Jeannie; Davidow, Lance S; Warshawsky, David. . Nature Genetics. 1999, 21 (4): 400–404. ISSN 1061-4036. doi:10.1038/7734.
- Costanzi, Carl; Pehrson, John R. . Nature. 1998, 393 (6685): 599–601. ISSN 0028-0836. doi:10.1038/31275.
- Maenner S, Blaud M, Fouillen L; et al. . PLoS Biol. January 2010, 8 (1): e1000276. PMC 2796953
 . PMID 20052282. doi:10.1371/journal.pbio.1000276.
. PMID 20052282. doi:10.1371/journal.pbio.1000276. - Beletskii A, Hong YK, Pehrson J, Egholm M, Strauss WM. . Proceedings of the National Academy of Sciences of the United States of America. July 2001, 98 (16): 9215–20. PMC 55400
 . PMID 11481485. doi:10.1073/pnas.161173098.
. PMID 11481485. doi:10.1073/pnas.161173098. - Mlynarczyk, Susanna K; Panning, Barbara. . Current Biology. 2000, 10 (24): R899–R903. ISSN 0960-9822. doi:10.1016/S0960-9822(00)00847-2.
- Björn Reinius, Chengxi Shi, Liu Hengshuo, Kuljeet Singh Sandhu, Katarzyna J. Radomska, Glenn D. Rosen, Lu Lu, Klas Kullander, Robert W. Williams and Elena Jazin. . BMC Genomics. November 2010, 11:614 (1): 614 [2011-02-09]. PMID 21047393. doi:10.1186/1471-2164-11-614. (原始内容存档于2010-11-09).
- Cheng, Mimi K.; Disteche, Christine M. . BioEssays. 2004, 26 (8): 821–824. ISSN 0265-9247. doi:10.1002/bies.20082.
- Johnston PG, Robinson ES. . School of Biological Sciences, Macquarie University, Sydney, New South Wales, Australia. [2011-02-09]. PMID 2824142. (原始内容存档于2017-11-01).
- Natekar, Prashant E.; DeSouza, Fatima M. . Indian Journal of Human Genetics. 2008, 14 (1): 7–8. ISSN 0971-6866. PMC 2840782
 . PMID 20300284. doi:10.4103/0971-6866.42320.
. PMID 20300284. doi:10.4103/0971-6866.42320. - E Watkiss, T Webb, G Rysiecki, N Girdler, E Hewett, and S Bundey. . PLoS Biol. (Department of Clinical Genetics, Birmingham Maternity Hospital, Edgbaston, UK). 1994-10 [2011-02-09]. PMID 1050120. (原始内容存档于2021-10-12).
- Knudsen GP. . Department of Adult Mental Health, Division of Mental Health, Norwegian Institute of Public Health, 0403 Oslo, Norway. 2009-05-02 [2011-02-09]. PMID 19411081. (原始内容存档于2016-09-20).
- Chabchoub G, Uz E, Maalej A, Mustafa CA, Rebai A, Mnif M, Bahloul Z, Farid NR, Ozcelik T, Ayadi H. . Laboratoire de Génétique Moléculaire Humaine, Faculté de Médecine de Sfax, Avenue Majida Boulila, Sfax, Tunisia. 2009-05-02 [2011-02-09]. PMID 2745787. (原始内容存档于2020-05-17).
- . American Medical Association. 1996-07-17 [2011-02-09]. (原始内容存档于2011-01-05) (英语).
- . 星洲日報. 2008-07-27 [2011-02-09]. (原始内容存档于2009-04-02).
- 李坤. . 北京科技報. 2008-08-11 [2019-05-28]. (原始内容存档于2008-08-16).
- Steven M. Carr. . Memorial University-Department of Biology. 1999 [2011-02-09]. (原始内容存档于2010-06-21).