組織蛋白
組織蛋白(英語:,或稱組蛋白)是真核生物体细胞染色质與原核細胞中的碱性蛋白质,和DNA共同组成核小体结构[1][2][3]。它们是染色质的主要蛋白质组分,作为DNA缠绕的线轴,并在基因调控中发挥作用,但是原核細胞組蛋白對基因調控的作用非常微弱[3]。没有组织蛋白,染色体中未缠绕的DNA将非常长(人类DNA中的长宽比超过1000万比1)。例如,每个人类二倍体细胞(含有23对染色体)具有约1.8米长的DNA,但是在组織蛋白上缠绕它具有大约90微米(0.09毫米)的染色质,当在有丝分裂期间复制和浓缩时,其导致约120微米的染色体[4]。
| 核心組織蛋白H2A/H2B/H3/H4 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
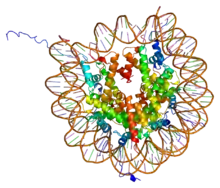 PDB rendering of Complex between nucleosome core particle (h3,h4,h2a,h2b) and 146 bp long DNA fragment based on 1aoi. | |||||||||||
| 鑑定 | |||||||||||
| 標誌 | Histone | ||||||||||
| Pfam | PF00125(旧版) | ||||||||||
| Pfam宗系 | CL0012(旧版) | ||||||||||
| InterPro | IPR007125 | ||||||||||
| SCOP | 1hio / SUPFAM | ||||||||||
| |||||||||||
| 連接組織蛋白H1和H5家族 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 PDB rendering of HIST1H1B based on 1ghc. | |||||||||||
| 鑑定 | |||||||||||
| 標誌 | Linker_histone | ||||||||||
| Pfam | PF00538(旧版) | ||||||||||
| InterPro | IPR005818 | ||||||||||
| SMART | SM00526 | ||||||||||
| SCOP | 1hst / SUPFAM | ||||||||||
| |||||||||||

分類和組織蛋白變體
存在五个主要的组织蛋白家族: H1/H5,H2A,H2B,H3和H4[2][5][6][7] 。组织蛋白H2A,H2B,H3和H4被称为核心组织蛋白(Core Histone),而组织蛋白H1/H5被称为连接组织蛋白(Linker Histone)。
在H2A、H2B、H3及H4這四種組織蛋白中的其中兩種稱為「核心組織蛋白」,並且集合成為八聚體的核小體核心顆粒。這種集合是將DNA的146對鹼基對以1.65左手超螺旋形圍在這個蛋白質線軸。連接組織蛋白H1將核小體核心顆粒與DNA的進入位點及E位點結合,因而可以將DNA緊扣在位,並且能容許形成更高層次的結構。最基本的形狀為一個10納米的纖維或一連串的珠子。這涉及將在每一個核小體之間約50對的DNA鹼基對圍在這些核小體上,這些DNA又稱為連接DNA。較高層次的結構包括有30及100納米的纖維,是在一般細胞內的結構。在減數分裂中,透過核小體與其他蛋白質的相互作用,合成染色體。合成的組織蛋白與DNA稱為染色質。
核心組織蛋白是高度保守的蛋白質,意即組織蛋白在氨基酸序列中有著非常小的改變。連接組織蛋白通常有著多於一種的形狀,對比核心組織蛋白是保守程度较低的。
在主要的組織蛋白類別中,亦存在一些異構體。它們有著相同的氨基酸序列及相似的核心結構,但卻有著不同的特徵。這些不同的組織蛋白通常帶著染色質的特別功能,就如與H3相似的CenpA是唯一的組織蛋白與染色體的著絲點聯合;H2A的異構體H2A.Z是與活性轉錄基因聯合與涉及在異染色體的形成;另一個H2A異構體H2A.X以雙鏈斷裂與DNA結合,並進行DNA修復。
H1
組織蛋白H1有著一個中央球狀結構域及長的C與N端尾巴,能將小珠子串結構圍成30納米大小的螺線管結構。對比其他種類的組織蛋白,H1的數量只為其他的一半。這是因為它不是構成核小體部份,而只是將DNA及核小體緊扣在一起。H1亦有著它的異構體,稱為組織蛋白H5。
H3
與組織蛋白H2A及H2B類似,組織蛋白H3有著一個主要的球狀結構域與長的N端尾巴,是組成小珠子串結構內的核小體的重要原素。它的N端尾巴從球狀核小體核心伸出,能進行多種影響細胞運作的表觀遺傳修飾。這些修飾包括將甲基及乙酰基共價附著於離氨酸或精氨酸,及絲氨酸或羥丁氨酸的磷酸化。離氨酸9的甲基化涉及基因沉默及在DNA內形成相對較不活躍的異染色質。組織蛋白H3的乙酰基化會在組織蛋白尾巴內不同的離氨酸位置出現,並且由組織蛋白乙酰轉移酶(HAT)所催化。離氨酸14的乙酰基化在基因中很普遍,亦會轉錄成為核糖核酸(RNA)。
以下是人類組蛋白的列表:
| 超級家族 | 家族 | 亞家族 | 成員 |
|---|---|---|---|
| 连接组织蛋白 | H1 | H1F | H1F0, H1FNT, H1FOO, H1FX |
| H1H1 | HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T | ||
| 核心组织蛋白 | H2A | H2AF | H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ |
| H2A1 | HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM | ||
| H2A2 | HIST2H2AA3, HIST2H2AC | ||
| H2B | H2BF | H2BFM, H2BFS, H2BFWT | |
| H2B1 | HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO | ||
| H2B2 | HIST2H2BE | ||
| H3 | H3A1 | HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J | |
| H3A2 | HIST2H3C | ||
| H3A3 | HIST3H3 | ||
| H4 | H41 | HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L | |
| H44 | HIST4H4 |
結構
核小體核心顆粒是由兩個H2A-H2B二聚物及兩個H3-H4二聚物結合而成,形成兩半接近對稱的蛋白質三級結構(2階旋轉對稱,即1個高分子是另一個的鏡像)。H2A-H2B及H3-H4二聚物本身亦呈現偽雙向對稱。
這四個核心組織蛋白(H2A、H2B、H3及H4)是在結構上相似及在進化中高度保存的,所有均有著一個「螺旋纏繞螺旋纏繞螺旋」的形狀,可以容許簡單的二聚化。它們在胺基酸結構上都有著一條長的尾巴,讓轉錄後修飾的進行。
總括來說,組織蛋白與DNA有著五種的相互作用:
- H2B、H3及H4的α螺旋兩極積聚正電,能與DNA的帶有負電荷的磷酸鹽分子團產生相互作用。
- 在DNA骨幹與胺基之間的氫鍵對組織蛋白的主鏈。
- 組織蛋白與DNA的脫氧核糖的非極性相互作用。
- 碱性胺基酸(如離氨酸及精氨酸)旁鏈與DNA磷酸氧旁鏈之間的鹽連及氫鍵。
- H3及H2B的N端尾巴的非特定副槽面插入至DNA分子的兩個副槽面。
組織蛋白最重要的基本性質,除了是協助與DNA的相互作用外,就是它的水溶性。
組織蛋白的轉譯後修飾會先在它的N端尾巴開始,再而在其球狀結構域進行。這種修飾包括有甲基化、瓜氨酸化、乙醯化、磷酸化、小泛素相關修飾化、泛素化及二磷酸腺苷核糖基化。這些影響著組織蛋白在基因調控的功能。
一般來說,活性的基因較少與組織蛋白聯繫,但非活性的基因會在間期中與組織蛋白聯合。組織蛋白的結構在進化上保存,這是因為任何有害的突變會造成嚴重的不適應性。
歷史
於1884年,艾布瑞契·科塞爾首先發現組織蛋白。直至1990年代早期,組織蛋白才被更多認識,並非純粹細胞核的惰性填充料,这部分基于马克·普塔什尼(Mark Ptashne)等人的模型,他们认为转录是被蛋白质-DNA和蛋白质-蛋白质相互作用在很大程度上被激活裸DNA模板,就像细菌一样。及後它的調控功能才被發現。
在1980年代,Yahli Lorch和罗杰·科恩伯格(Roger Kornberg)[8]表明,核心启动子上的核小体体外阻止了转录的启动,迈克尔·格伦斯坦(Michael Grunstein)[9]证明组蛋白在体内抑制转录,导致核小体为 一般基因阻遏物。
功能
参考文献
- Youngson RM. . Glasgow: HarperCollins. 2006. ISBN 0-00-722134-7.
- Cox M, Nelson DR, Lehninger AL. . San Francisco: W.H. Freeman. 2005. ISBN 0-7167-4339-6.
- 杨荣武, 生物化学原理第三版. . 北京: 高等教育出版社. 2018. ISBN 9787040500813.
- Redon C, Pilch D, Rogakou E, Sedelnikova O, Newrock K, Bonner W. . Current Opinion in Genetics & Development. Apr 2002, 12 (2): 162–9. PMID 11893489. doi:10.1016/S0959-437X(02)00282-4.
- . National Center for Biotechnology Information. [13 January 2017]. (原始内容存档于2016-12-20).
- Bhasin M, Reinherz EL, Reche PA. . Journal of Computational Biology. 2006, 13 (1): 102–12. PMID 16472024. doi:10.1089/cmb.2006.13.102.
- Hartl DL, Freifelder D, Snyder LA. . Boston: Jones and Bartlett Publishers. 1988. ISBN 0-86720-090-1.
- Lorch Y, LaPointe JW, Kornberg RD. . Cell. Apr 1987, 49 (2): 203–10. PMID 3568125. doi:10.1016/0092-8674(87)90561-7.
- Kayne PS, Kim UJ, Han M, Mullen JR, Yoshizaki F, Grunstein M. . Cell. Oct 1988, 55 (1): 27–39. PMID 3048701. doi:10.1016/0092-8674(88)90006-2.
- Ning Song, Jie Liu, Shucai An, Tomoya Nishino, Yoshitaka Hishikawa and Takehiko Koji. . Acta Histochemica et Cytochemica. 2011, 44 (4). doi:10.1267/ahc.11027.
外部链接
| 维基词典中的词条「」。 |
- HistoneDB 2.0 - 组织蛋白和变体数据库 (页面存档备份,存于) -- 在美国国家生物技术信息中心(NCBI)
- Chromatin, Histones & Cathepsin (页面存档备份,存于); PMAP The Proteolysis Map-animation