次锰酸钾
次锰酸钾(K3MnO4)是一种淡蓝色的盐,它是很少见的次锰酸盐。
| 次锰酸钾 | |
|---|---|
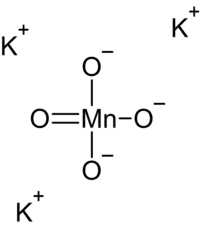 | |
| IUPAC名 potassium manganate(V) potassium tetraoxidomanganate(3−) | |
| 性质[1] | |
| 化学式 | K3MnO4 |
| 236.23 g·mol⁻¹ | |
| 外观 | 淡蓝色固体 |
| λmax | 670 nm (ε = 900 dm3 mol−1 cm−1) nm |
| 相关物质 | |
| 其他阴离子 | 锰酸钾 高锰酸钾 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
最早制得的次锰酸盐是Na3MnO4·10H2O,但后来发现它实际上是Na3MnO4·0.25NaOH·10H2O。[2]
- MnO−
4 + SO2−
3 + H2O → MnO3−
4 + SO2−
4 + 2 H+
- MnO−
- 2 MnO2−
4 + H2O2 + 2 OH− → 2 MnO3−
4 + O2 + 2 H2O
- 2 MnO2−
- 2 MnO2−
4 + C
8H
7O−
3 + 2 OH− → 2 MnO3−
4 + C
8H
5O−
3 + 2 H2O
- 2 MnO2−
- 2 MnO2 + 3 OH− → MnO3−
4 + MnO(OH) + H2O
- 2 MnO2 + 3 OH− → MnO3−
性质
次锰酸盐在无水和无二氧化碳的条件下能稳定存在。在水溶液中因歧化而不稳定,尤其是在碱性溶液中。[3][4]估计pH=14的水溶液中它的标准电极电势如下所示:[6][7][8]
- MnO2−
4 + e− ⇌ MnO3−
4 E = +0.27 V - MnO3−
4 + e− + 4 H2O ⇌ MnO2 + 6 OH− E = +0.96 V
歧化反应被认为经过质子化的中间体,[8]因为HMnO2−
4 ⇌ MnO3−
4 + H+的酸度系数的负对数,即pKa约为13.7 ± 0.2。[9]然而,K3MnO4能与Ca2Cl(PO4)共结晶并析出,使得人们可以用紫外可见吸收光谱来研究锰(V)酸根离子。[3][10]
用高锰酸钾或锰酸钾氧化有机化合物时,次锰酸根离子经常作为中间体出现。[2]
参考资料
- Lee, Donald G.; Chen, Tao, , J. Am. Chem. Soc., 1993, 115 (24): 11231–36, doi:10.1021/ja00077a023.
- . 北京: 科学出版社. : P46–47. ISBN 7-03-002238-6.
- Cotton, F. Albert; Wilkinson, Geoffrey, 4th, New York: Wiley: 746, 1980, ISBN 0-471-02775-8.
- Greenwood, Norman N.; Earnshaw, A. . Oxford: Pergamon. 1984: 1221–22. ISBN 0-08-022057-6..
- Lee, Donald G.; Chen, Tao, , J. Am. Chem. Soc., 1989, 111 (19): 7534–38, doi:10.1021/ja00201a039.
- Weast, Robert C. (编). 62nd. Boca Raton, FL: CRC Press. 1981: D-134. ISBN 0-8493-0462-8..
- , WebElements, [2010-06-26], (原始内容存档于2021-01-17).
- Sekula-Brzezińska, K.; Wrona, P. K.; Galus, Z., , Electrochim. Acta, 1979, 24 (5): 555–63, doi:10.1016/0013-4686(79)85032-X.
- Rush, J. D.; Bielski, B. H. J., , Inorg. Chem., 1995, 34 (23): 5832–38, doi:10.1021/ic00127a022.
- Carrington, A.; Symons, M. C. R., , J. Chem. Soc., 1956: 3373–80, doi:10.1039/JR9560003373.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.