珀金反应
Perkin反应(珀金反应、浦尔金反应)
| 珀金反应 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 命名根据 | 威廉·珀金 | ||||||||||
| 反应类型 | 缩合反应 | ||||||||||
| 反应 | |||||||||||
| |||||||||||
| 标识 | |||||||||||
| RSC序号 | RXNO:0000003 | ||||||||||
| | |||||||||||
芳香醛与酸酐在碱性催化剂存在下,发生类似羟醛缩合反应得到 β-芳基-α,β-不饱和羧酸。通常使用与酸酐对应的羧酸盐作催化剂。
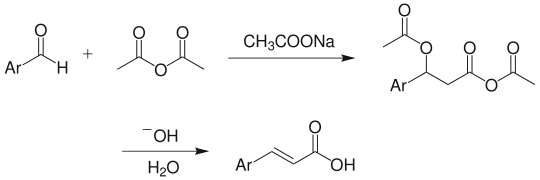
例如,苯甲醛与乙酸酐在乙酸钠催化下在 170~180°C 沸腾加热5小时,得到肉桂酸。
反应机理
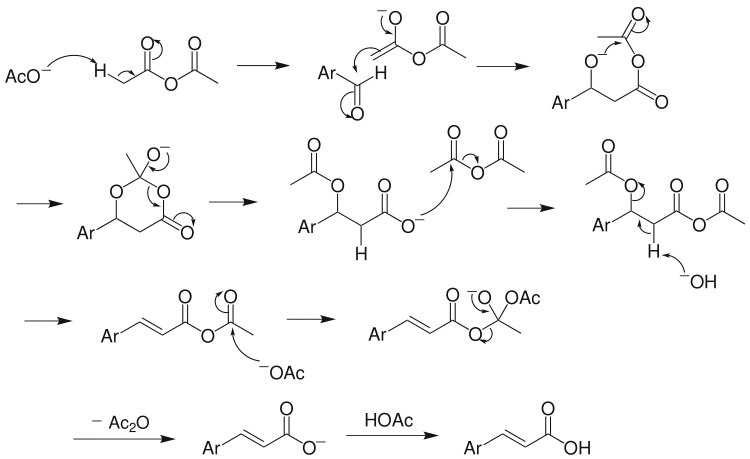
羧酸盐的负离子作为质子接受体,与酸酐作用,产生羧酸,同时生成一个羧酸酐的α-负离子,该负离子与醛发生亲核加成产生烷氧负离子,然后向分子内的羰基进攻,关环,从另一侧开环,得到羧酸根负离子,与酸酐反应产生混酐,这个混酐发生E2消除,失去质子及酰氧基,产生一个不饱和的酸酐,它受亲核试剂进攻发生加成-消除,再经酸化,最后得到芳基不饱和羧酸,主要是反式羧酸。[6]
底物要求
羰基化合物
Perkin 反应一般只局限于芳香醛类。某些杂环醛,如呋喃甲醛[7] 能发生反应产生呋喃丙烯酸,这个产物是医治血吸虫病药物呋喃丙胺的原料。
取代基对 Perkin 反应的影响与取代基的类型和取代位置有关。硝基和卤素等吸电子基团,无论在苯环任何位置都对反应有促进作用,但在邻位时作用大于间位,间位大于对位。当甲氧基位于醛基对位时,对反应产率和速度都有不利的影响;但当甲氧基位于邻位时,稍对反应有利。
醛基的间位或对位有羟基的底物能取得较满意的结果。邻位有羟基的水杨醛与乙酸酐在乙酸钠作用下,一步就得到香豆素,它是顺式香豆酸的内酯:
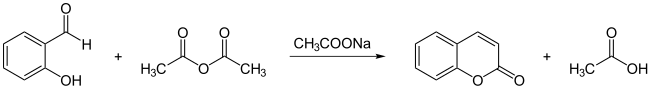
Perkin反应一般是产生含有反式双键的羧酸,产物中两个较大的基团处于反型。上述反应也会产生少量的反式香豆酸(邻羟基肉桂酸),但反式香豆酸不能生成内酯。也可得到反式的酚基氧-乙酰化衍生物。
芳香二醛,如邻苯二甲醛、间苯二甲醛、对苯二甲醛,均可发生 Perkin 反应转变为相应的苯二丙烯酸。
脂肪族亦能进行 Perkin 反应,但反应进行不顺利,产率极低。[8] 这是因为脂肪醛活性低和副产物的影响,而较高级的同系物从戊醛开始又增加了链长所引起的空间阻碍。[9]
芳基烷基酮和二芳基酮只能同具有强活泼亚甲基的化合物如苯乙酸发生反应。
参见
参考资料
- W. H. Perkin F.R.S. . J. Chem. Soc. 1868, 21 (53): 181–186. doi:10.1039/JS8682100181.
- W. H. Perkin F.R.S. . J. Chem. Soc. 1877, 31: 388–427. doi:10.1039/JS8773100388.
- Johnson, J. R.; Org. React. 1942, 1, 210.
- House, H. O. Modern Synthetic Reactions (W. A. Benjamin, Menlo Park, California, 2nd ed, 1972) pp 660-663.
- Rosen, T.; Comp. Org. Syn. 1991, 2, 395-408.
- Jie Jack Li. 3rd ed. Springer Berlin Heidelberg. 2006: 454–455. doi:10.1007/3-540-30031-7. ISBN 978-3-540-30030-4.
- John R. Johnson. "Furylacrylic acid (页面存档备份,存于)". Organic Syntheses, Coll. Vol. 3, p.425 (1955); Vol. 25, p.51 (1945).
- Malcolm Crawford, W. T. Little. . J. Chem. Soc. 1959: 722–728. doi:10.1039/JR9590000722.
- Malcolm Crawford, W. T. Little. . J. Chem. Soc. 1959: 732–734. doi:10.1039/JR9590000732.