肉桂酸
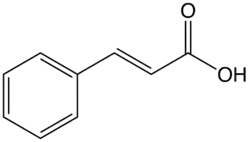
肉桂酸(英語:,IUPAC名:(E)-3-苯基-2-丙烯酸),分子式為C6H5CHCHCOOH。是微溶於水的白色結晶化合物。歸類為不飽和羧酸,它天然存在於許多植物。它易溶於許多有機溶劑。[3]它同時存在順式和反式異構體,雖然後者是較常見。[4]
| 肉桂酸 | |
|---|---|
 | |
 | |
| IUPAC名 (E)-3-苯基-2-丙烯酸 (E)-3-phenylprop-2-enoic acid | |
| 别名 | 桂皮酸 |
| 识别 | |
| CAS号 | 140-10-3 |
| PubChem | 444539 |
| ChemSpider | 392447 |
| SMILES |
|
| InChI |
|
| InChIKey | WBYWAXJHAXSJNI-VOTSOKGWBT |
| ChEBI | 35697 |
| KEGG | C00423 |
| IUPHAR配体 | 3203 |
| 性质 | |
| 化学式 | C6H5CHCHCOOH |
| 148.17 g·mol⁻¹ | |
| 外观 | 白色单斜晶体 |
| 氣味 | 蜂蜜[1] |
| 密度 | 1.2475 g/cm3[2] |
| 熔点 | 133 °C[2] |
| 沸点 | 300 °C[2] |
| 溶解性(水) | 0.5 g/L[2] |
| pKa | 4.44 |
| 危险性 | |
欧盟危险性符号 刺激性 Xi 刺激性 Xi | |
| 警示术语 | R:R36 |
| 安全术语 | S:S25 |
| 闪点 | > 100 °C[2] |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
存在和生产
参考资料
- . flavornet.org. [2021-08-30]. (原始内容存档于2021-08-30).
- Record in the GESTIS Substance Database from the IFA
- Budavari, Susan (编), 12th, Merck, 1996, ISBN 0911910123
- Garbe, Dorothea, , , Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a07_099
- Vogt, T. . Molecular Plant. 2010, 3 (1): 2–20. PMID 20035037. doi:10.1093/mp/ssp106
 .
. - Claisen, L. [On the preparation of cinnamic acid and its homologues]. Berichte der Deutschen Chemischen Gesellschaft. 1890, 23: 976–978. doi:10.1002/cber.189002301156.
- Tieze, L. . Mill Vall, CA. 1988: 1988.
- F. K. Thayer. . Organic Syntheses. 1925, 5: 83. doi:10.15227/orgsyn.005.0083.
- Jana A, Modi KK, Roy A, Anderson JA, van Breemen RB, Pahan K. . Journal of Neuroimmune Pharmacology. June 2013, 8 (3): 739–55. PMC 3663914
 . PMID 23475543. doi:10.1007/s11481-013-9447-7.
. PMID 23475543. doi:10.1007/s11481-013-9447-7.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
