过氧磷酸
过氧磷酸,化学式 H
3PO
5,是一种磷的含氧酸,易溶于水。它是两种磷的过氧酸之一,另一种是过氧焦磷酸。
| 过氧磷酸 | |
|---|---|
 | |
| IUPAC名 peroxyphosphoric acid | |
| 系统名 (dioxidanido)dihydroxidooxidophosphorus | |
| 英文名 | |
| 别名 |
|
| 识别 | |
| CAS号 | 13598-52-2 |
| PubChem | 6326786 |
| ChemSpider | 4885506 |
| SMILES |
|
| InChI |
|
| ChEBI | 29282 |
| 性质 | |
| 化学式 | H3PO5 |
| 114.00 g·mol⁻¹ | |
| 外观 | 无色液体 |
| 溶解性 | 可溶于乙腈和1,4-二氧六环 |
| pKa | 0.92±0.10(25 °C)[1] |
| 相关物质 | |
| 相关化学品 | 过氧焦磷酸 磷酸 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
历史
两种磷的过氧酸都是在1910年由Julius Schmidlin和Paul Massini通过五氧化二磷与高浓度过氧化氢之间的反应首次合成并表征的。[2]不过,这个反应非常剧烈,很难控制。除了五氧化二磷之外,还报道了从偏磷酸和焦磷酸开始合成的方法。
Gerrit Toennies 在1937年描述了一种通过引入惰性溶剂乙腈来制备过氧磷酸的不太剧烈的方法。该方法被证明不适用于乙醚或异戊醇溶剂。[3]
制备
过氧磷酸最广泛使用的制备方法是将过氧焦磷酸盐在强酸如高氯酸中水解。[4]它的前体过氧焦磷酸盐则可以通过电解磷酸盐而成。[5]
它也可以由五氧化二磷与高浓度过氧化氢在乙腈或四氯化碳等惰性溶剂中反应而成。[4]
性质

过氧磷酸是一种无色的黏液体。它被分子内氢键稳定化。[6]过氧磷酸是三元酸,酸度系数 pKa1 = 1.1、pKa2 = 5.5 和pKa3 = 12.8。在水溶液中,它会缓慢水解成过氧化氢和磷酸。[7]
过氧磷酸水解的半衰期取决于 pH 值和温度,在 35 °C 下约为 31 小时,在 61 °C 下约为 2.5 小时。[7]它的乙腈溶液也会缓慢降解,在 5°C 下储存 26 天后会损失 30% 的活性氧。[6]相对稳定的过氧磷酸盐可以由中和反应产生,例如和氢氧化钾反应产生吸湿性的过氧磷酸二氢钾 KH2PO5。[5]
用途和反应
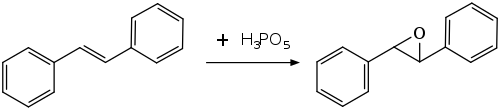
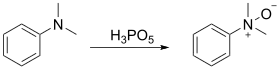
过氧磷酸在有机合成中用作亲电试剂,用于氧化烯烃、炔烃、芳香族化合物和胺。由于它的强酸性,它只能制备相对对酸稳定的环氧化物,例如从(E)-二苯基乙烯制备(E)-二苯基环氧乙烷。不太稳定的环氧化物被裂解或进一步反应,它和环己烯、苯乙烯和α-甲基苯乙烯的反应不会形成可分离的环氧化物。在苯乙烯和α-甲基苯乙烯的情况下,酸催化的烷基迁移导致主要产物分别为苯乙酸和2-苯基丙酸。[8]
过氧磷酸在室温下氧化二苯基乙炔会产生二苯基乙二酮,可能通过了一个环氧乙烯衍生物中间体。[9]

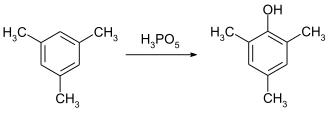
过氧磷酸是芳香环羟基化的有效试剂。在室温下,它可以在四小时内把均三甲苯羟基化成2,4,6-三甲基苯酚。[10]
在拜耳-维立格氧化反应中,过氧磷酸是一种有效的氧化剂。苯乙酮衍生物可以在 30 °C 下以高产率转化为相应的苯乙酸酯。与使用过氧苯甲酸来氧化相比,反应速率大约高出100倍。[11]

参考资料
- Calculated using Advanced Chemistry Development (ACD/Labs) Software V11.02 (© 1994-2021 ACD/Labs). Retrieved from SciFinder. [2021-09-07].
- Schmidlin, Julius; Massini, Paul. . Ber. Dtsch. Chem. Ges. 1910, 43 (1): 1162–1171. doi:10.1002/cber.191004301195.
- Toennies, Gerrit. . J. Am. Chem. Soc. 1937, 59 (3): 555–557. doi:10.1021/ja01282a037.
- Zhu, Tian; Chang, Hou-Min; Kadia, John F. . Can. J. Chem. 2003, 81 (2): 156–160. doi:10.1139/v03-010.
- Harald, Jakob; Leininger, Stefan; Lehmann, Thomas; Jacobi, Sylvia; Gutewort, Sven. . . Wiley‐VCH Verlag. 2007: 310–311. ISBN 9783527306732. doi:10.1002/14356007.a19_177.pub2.
- Rao, A. Somasekar; Mohan, H. Rama. . . John Wiley & Sons. 2001. ISBN 9780470842898. doi:10.1002/047084289X.rm287m.
- Battaglia, Charles J.; Edwards, John O. . Inorg. Chem. 1965, 4 (4): 552–558. doi:10.1021/ic50026a024.
- Ogata, Yoshiro; Tomizawa, Kohtaro; Ikeda, Toshiyuki. . J. Org. Chem. 1979, 44 (14): 2362–2364. doi:10.1021/jo01328a006.
- Ogata, Yoshiro; Sawaki, Yasuhiko; Ohno, Takashi. . J. Am. Chem. Soc. 1982, 104 (1): 216–219. doi:10.1021/ja00365a039.
- Ogata, Yoshiro; Sawaki, Yasuhiko; Tomizawa, Kohtaro; Ohno, Takashi. . Tetrahedron. 1981, 37 (8): 1485–1486. doi:10.1016/S0040-4020(01)92087-3.
- Ogata, Yoshiro; Tomizawa, Kohtaro; Ikeda, Toshiyuki. . J. Org. Chem. 1978, 43 (12): 2417–2419. doi:10.1021/jo00406a025.
- Ogata, Yoshiro; Tomizawa, Kohtaro; Morikawa, Takashi. . J. Org. Chem. 1979, 44 (3): 352–355. doi:10.1021/jo01317a009.