阿哌沙班
阿哌沙班(英語:)以Eliquis(艾必克凝)等品牌銷售,是一種抗凝劑,透過直接抑制Xa因子來治療和預防靜脈血栓,並用來預防患有非瓣膜性心房顫動的人發生中風。[5][6][7]尤其會被用來預防髖關節置換或膝關節置換手術後,以及有血栓病史患者發生血栓的情況。[5][7]它是抗凝劑華法林的替代用藥,但不需經血液檢查[5]來監測或是飲食控制。[8]此種藥物透過口服方式給藥。[5]
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Eliquis(艾必克凝), 及其他品牌名稱 |
| 其他名稱 | BMS-562247-01 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a613032 |
| 核准狀況 | |
| 懷孕分級 | |
| 给药途径 | 口服給藥 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 藥物動力學數據 | |
| 生物利用度 | ~50% |
| 血漿蛋白結合率 | ~87% |
| 药物代谢 | CYP3A4, CYP3A5, CYP1A2 and others |
| 生物半衰期 | 9–14 h |
| 排泄途徑 | 膽管 (75%), 腎臟 (25%) |
| 识别 | |
| |
| CAS号 | 503612-47-3 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.167.332 |
| 化学 | |
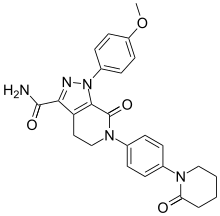
| 化学式 | C25H25N5O4 |
| 摩尔质量 | 459.51 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
服用阿哌沙班常見的副作用包括出血和噁心。[5][6]其他副作用還有脊髓硬膜外血腫和過敏反應。[5]不建議個體在懷孕或母乳哺育期間使用。[1][6]對於患有輕度腎病變的人來說,似乎相對安全。[6]它比華法林會較少與其他藥物發生相互作用。[9]阿哌沙班是一種Xa因子直接抑制劑。[5]
輝瑞和必治妥施貴寶兩家藥廠於2007年開始合作開發阿哌沙班作為抗凝劑使用。[10]此藥物於2011年5月經歐盟批准用於醫療用途,並於2012年12月受到美國批准作醫療用。[2][5][11]它是種列於世界衛生組織基本藥物標準清單之中的藥物。[12]阿哌沙班於2020年在美國最常使用的處方藥中排名第48,開立的處方箋超過1,300萬張。[13][14]在美國以外,有通用名藥物(又稱學名藥)可供使用。[7][15]
醫療用途
阿哌沙班適用的身體狀況如下:[4]
- 降低非瓣膜性心房顫動患者發生中風和栓塞的風險。
- 預防深靜脈血栓(DVT)。經歷膝關節或髖關節置換手術的人發生DVT,可能會導致肺栓塞 (PE)。
- 治療DVT和PE。
- 治療DVT和PE之後,可用於降低其復發的風險。
在歐盟,阿哌沙班適用於接受擇期性髖關節或膝關節置換手術成人的靜脈血栓事件(VTE)預防、預防具有多種危險因素的非瓣膜性心房顫動(NVAF)成人的中風和全身性栓塞、治療成人深部靜脈血栓 (DVT) 和肺栓塞 (PE),以及預防成人的復發性DVT和PE。[2]
副作用
作用機轉
阿哌沙班是一種高選擇性、口服後易被身體吸收、游離和血液凝結Xa因子的可逆轉直接抑制劑。 Xa因子的功能是催化凝血酶原(prothrombin)轉化為凝血酶,凝血酶是凝血級聯中的最終酶,負責形成纖維蛋白凝塊。[24]阿哌沙班對血小板凝結沒直接影響,但透過抑制Xa因子,可間接減少凝血酶誘導形成血栓。[4]
歷史
阿哌沙班於2011年5月在歐盟獲准用於醫療用途。[2]
必治妥施貴寶和輝瑞兩藥廠於ARISTOTLE臨床試驗(Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation - "阿哌沙班用於降低心房顫動患者中風及其他血栓栓塞事件風險"的簡稱)結束後,向FDA提交藥物批准的新藥申請(NDA)。[25][11]阿哌沙班於2012年12月28日被FDA核准用於預防心房顫動患者發生中風。[11][26]於2014年3月13日被批准用於預防近期接受膝關節或髖關節置換手術患者發生新增深部靜脈血栓形成和肺栓塞的風險。[27][28]於2014年8月21日被核准用於治療復發性深部靜脈栓塞和肺栓塞的新增狀況。[27][29]藥物在開發過程中被稱為BMS-562247-01。[30]此產品的銷售額佔必治妥施貴寶於2019年底季度營收的30%。[31]
社會與文化
經濟學
FDA於2019年12月核准邁蘭和Micro Labs兩家藥廠共同生產阿哌沙班學名藥。[32][31][7]必治妥施貴寶和輝瑞迅速採取行動,阻止此兩家藥廠生產,並在與其他25家公司達成專利訴訟和解後,又於2020年8月贏得針對Sigmapharm、Sunshine Lake和Unichem三家藥廠的專利權侵權訴訟。[33][34]美國聯邦巡迴區上訴法院於2021年9月維持這項判決。[35]阿哌沙班的學名藥很可能最早要到2026年才能在美國上市,也可能會延到2031年。[15]
加拿大學名藥廠奧貝泰克於2022年7月獲得將此藥物上市的批准。[36][37]
阿哌沙班是根據美國《2022年降低通脹法》被提議進行價格協商的十種藥物之一。根據必治妥施貴寶的數據,每位患者每月平均為Eliquis(艾必克凝)支付的費用為55美元。[38]
參考文獻
- . Drugs.com. 2019-06-21 [2020-08-13].
- . European Medicines Agency. 2018-09-17 [2020-04-22]. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- . (emc). 2022-05-03 [2022-10-08].
- . DailyMed. 2019-11-26 [2020-04-22].
- . Drugs.com. American Society of Health-System Pharmacists. [2019-03-27].
- 76. Pharmaceutical Press. 2018: 124–125. ISBN 9780857113382.
- . U.S. Food and Drug Administration (FDA). 2019-12-23 [2019-12-23]. (原始内容存档于2019-12-23).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。 - Hall H. . Skeptical Inquirer (Amherst, New York: Center for Inquiry). September-October 2020.
- Kiser K. . Springer. 2017: 11. ISBN 9783319546438.
- . Pfizer (新闻稿). [2021-12-25]. (原始内容存档于2015-09-10).
- . U.S. Food and Drug Administration (FDA). 2013-2-13 [2019-12-23].
- World Health Organization. . Geneva: World Health Organization. 2021. hdl:10665/345533
 . WHO/MHP/HPS/EML/2021.02.
. WHO/MHP/HPS/EML/2021.02. - . ClinCalc. [2022-10-07].
- . ClinCalc. [2022-10-07].
- . BioSpace. [2021-11-29].
- (PDF). National Institute for Health and Care Excellence. January 2013 [2016-02-26].
- Gómez-Outes A, Terleira-Fernández AI, Calvo-Rojas G, Suárez-Gea ML, Vargas-Castrillón E. . Thrombosis. 2013, 2013: 640723. PMC 3885278
 . PMID 24455237. doi:10.1155/2013/640723
. PMID 24455237. doi:10.1155/2013/640723  .
. - Lowenstern A, Al-Khatib SM, Sharan L, Chatterjee R, Allen LaPointe NM, Shah B, et al. . Annals of Internal Medicine. December 2018, 169 (11): 774–787. PMC 6825839
 . PMID 30383133. doi:10.7326/M18-1523.
. PMID 30383133. doi:10.7326/M18-1523. - . U.S. Food and Drug Administration (FDA). 2015-12-02 [2020-04-22].
- . U.S. Food and Drug Administration. 2015-12-02 [2020-04-22].
- . European Medicines Agency (EMA). 2020-03-27 [2020-04-22].
- . DailyMed. 2019-01-08 [2019-12-23].
- . U.S. Food and Drug Administration (FDA). 2018-12-31 [2020-04-22].
- Frost C, Wang J, Nepal S, Schuster A, Barrett YC, Mosqueda-Garcia R, et al. . British Journal of Clinical Pharmacology. February 2013, 75 (2): 476–487. PMC 3558798
 . PMID 22759198. doi:10.1111/j.1365-2125.2012.04369.x.
. PMID 22759198. doi:10.1111/j.1365-2125.2012.04369.x. - Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. . The New England Journal of Medicine. September 2011, 365 (11): 981–992. PMID 21870978. S2CID 43262809. doi:10.1056/NEJMoa1107039
 .
. - Cada DJ, Levien TL, Baker DE. . Hospital Pharmacy. June 2013, 48 (6): 494–509. PMC 3839491
 . PMID 24421512. doi:10.1310/hpj4806-494.
. PMID 24421512. doi:10.1310/hpj4806-494. - . U.S. Food and Drug Administration (FDA). [2019-12-23].
- Neale T. . MedPage Today. 2014-03-14 [2015-09-17].
- (新闻稿). Pfizer. 2014-08-21 [2016-02-26].
- . PubChem, US National Library of Medicine. 2022-08-27 [2022-09-02].
- . Business Medical Dialogues (New Delhi, India: Minerva Medical Treatment). 2019-12-24 [2019-12-24].
- . U.S. Food and Drug Administration (FDA). t 2020-08-05 [2023-06-30]. (原始内容存档于2023-06-30).
- . JD Supra. [2021-11-30].
- . BioPharma Dive. [2021-11-30].
- . The National Law Review. [2021-11-30].
- Levy S. . Drugstore News. 2022-08-01 [2022-09-02].
- . Apotex (新闻稿). 2022-07-20 [2023-06-29].
- Kansteiner, Fraiser. . 2023-08-29 [2023-08-31].