利伐沙班
利伐沙班(英语:Rivaroxaban),以Xarelto等品牌销售,是一种用于治疗和预防血栓的抗凝药物(血液稀释剂)。具体而言,它用于治疗深静脉血栓形成和肺栓塞,并预防心房颤动和髋关节或膝关节手术后的血栓。它是口服的。[6]
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Xarelto, others |
| 其他名稱 | BAY 59-7939 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a611049 |
| 核准狀況 |
|
| 懷孕分級 | |
| 给药途径 | By mouth |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 藥物動力學數據 | |
| 生物利用度 | 80–100%; Cmax = 2–4 hours (10 mg oral)[4] |
| 药物代谢 | CYP3A4, CYP2J2 and CYP-independent mechanisms[4] |
| 生物半衰期 | 5–9 hours in healthy subjects aged 20 to 45[4][5] |
| 排泄途徑 | 2/3 metabolized in liver and 1/3 eliminated unchanged[4] |
| 识别 | |
| |
| CAS号 | 366789-02-8 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB配體ID | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.210.589 |
| 化学 | |
| 化学式 | C19H18ClN3O5S |
| 摩尔质量 | 435.88 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
常见的副作用包括出血。[6]其他严重的副作用可能包括脊髓硬膜外血肿和过敏性休克。[6]目前尚不清楚在怀孕和哺乳期间使用是否安全。[1]与华法林相比,它与其他药物的相互作用较少。[7]它通过阻断凝血蛋白凝血因子Xa的活性起作用。[6]
利伐沙班于2007年获得专利,并于2011年在美国获批用于医疗用途。[8]在美国,直到 2024 年它才能作为仿制药使用。[9][10]它被列入世界卫生组织基本药物标准清单里。[11]在2019年,它是美国第91种最常用的处方药,有超过800万张处方。[12][13]
医用
_tablets.jpg.webp)
在非瓣膜性心房颤动患者中,它在预防缺血性中风和栓塞事件方面似乎与华法林一样有效。[16][17]与华法林相比,利伐沙班与严重和致命出血事件的发生率较低相关,尽管利伐沙班与消化道出血率较高有关。[18]
禁忌
由于与控制出血相关的困难,利伐沙班应在手术前至少24小时停用,然后在确定充分止血后立即重新开始。[20]
剂量建议不建议将利伐沙班与已知为强联合CYP3A4/P-糖蛋白抑制剂的药物合用,因为这会导致利伐沙班的血浆浓度显着升高。[3][21]
不利影响
最严重的不良反应是出血,包括严重的内出血。[22][23][24]与华法林相比,利伐沙班的严重和致命出血事件发生率较低,但消化道出血发生率较高。[25]
截止2015年,上市后评估显示肝毒性,需要进一步研究来量化这种风险。[26][27]在2015年,在FDA不良事件报告系统(AERS)的定期监测药物中,利伐沙班被报告的严重伤害病例数最多。[28]
逆转剂
2014年10月,Portola Pharmaceuticals完成了andexanet alfa作为凝血因子Xa抑制剂的解毒剂且副作用少的I期和II期临床试验,并启动了三期试验。[29][30] Andexanet alfa于2018年5月获得美国食品和药物管理局的批准,商品名为 Andexxa。[31][32]
作用机制
利伐沙班抑制凝血酶原酶复合物中游离和结合的凝血因子Xa。[33]它是一种选择性直接凝血因子Xa抑制剂,起效时间为2.5至4小时。[34]凝血因子Xa的抑制会中断凝血级联的内在和外在途径,从而抑制凝血酶的形成和血栓的发展。利伐沙班不抑制凝血酶(激活的凝血因子II),并且已证明对血小板没有影响。[4]它允许可预测的抗凝和剂量调整以及常规凝血监测;[4]不需要饮食限制。[35]
普通肝素、低分子量肝素和磺达肝素也通过与循环抗凝血酶结合而间接抑制凝血因子Xa的活性并且必须通过注射,而口服活性华法林、苯丙香豆素和醋硝香豆素是维生素K拮抗剂,可降低许多凝血因子,包括凝血因子Xa。[36]
利伐沙班在广泛的患者(年龄、性别、体重、种族)中具有可预测的药物代谢动力学,并且在八倍剂量范围(5-40mg)内具有平坦的剂量反应。[37]口服生物利用度是剂量依赖性的。[38]10mg以下的利伐沙班剂量可以在有或没有食物的情况下服用,因为它显示出高生物利用度,而与是否食用食物无关。[39]如果以15mg或20mg口服剂量给予利伐沙班,则需要与食物一起服用以帮助药物吸收并达到适当的生物利用度(≥80%)。[39]
化学
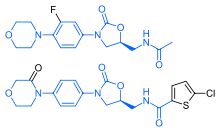
利伐沙班与抗生素利奈唑胺有着惊人的结构相似性:两种药物具有相同的𫫇唑烷酮衍生核心结构。[40]因此,利伐沙班已被研究了任何可能的抗菌作用和线粒体毒性的可能性,线粒体毒性是长期使用利奈唑胺的已知并发症。[41]研究发现,利伐沙班及其代谢物都对革兰氏阳性菌没有任何抗生素作用。至于线粒体毒性,2008年之前发表的体外研究发现风险很低。[40]
社会与文化
经济性
根据美国最大的药房福利管理公司快捷药方的数据,使用利伐沙班而非华法林的成本要高出70倍。[4]截至2016年,拜耳公司声称该药物已在130个国家获得许可,超过2300万患者接受了治疗。[42]
同意许可
在2008年9月,加拿大卫生部授予利伐沙班的上市许可,用于预防接受选择性全髋关节置换术或全膝关节置换术患者的静脉血栓。[43]
同月,欧盟委员会也授予利伐沙班的上市许可,用于预防接受择期髋关节和膝关节置换术的成人静脉血栓栓塞症。[44][2]
在2011年7月1日,美国食品和药物管理局批准利伐沙班在接受髋关节和膝关节置换手术的成人中预防可能导致肺栓塞的深静脉血栓形成。
合法举动
在2019年3月25日,在美国有25,000多起关于利伐沙班的诉讼以7.75亿美元和解,以支付给受影响的人。原告指责制药商没有警告出血风险,声称如果向医生和患者提供足够的信息,他们的伤害是可以避免的。[46]
研究
杜克大学医学院的研究人员被指控隐瞒用于评估利伐沙班的临床数据。[47]杜克大学在一项名为ROCKET AF试验的临床试验中测试了利伐沙班。[48]该临床试验于2011年发表在《新英格兰医学杂志》上[49]并由时任FDA专员罗伯特·卡利夫领导,[50][49]发现利伐沙班在降低房颤患者缺血性卒中的可能性方面比华法林更有效。[49]该研究的有效性在2014年受到质疑,当时制药赞助商拜耳公司和强生公司透露所使用的INRatio血液监测设备运行不正常。[47][48]杜克团队随后在2016年2月发表的一项分析发现,这对于试验的疗效和安全性没有显着影响。[51]
临床试验中少数族裔的代表性不足已经被经注意到。与华法林相比,不同种族亚组的疗效和安全性相似。[49]
参考文献
- . Drugs.com. [March 3, 2019]. (原始内容存档于2019-03-27).
- . European Medicines Agency (EMA). [November 13, 2020]. (原始内容存档于2023-01-27).
- . DailyMed. [November 13, 2020]. (原始内容存档于2021-04-19).
- . Bayer Schering Pharma AG. 2008 [February 11, 2009]. (原始内容存档于2010-07-27).
- Abdulsattar Y, Bhambri R, Nogid A. . P & T. May 2009, 34 (5): 238–44. PMC 2697099
 . PMID 19561868.
. PMID 19561868. - . Drugs.com. American Society of Health-System Pharmacists. [March 3, 2019]. (原始内容存档于2019-03-27).
- Kiser K. . Springer. 2017: 11. ISBN 9783319546438.
- . Drugs.com. [May 9, 2017]. (原始内容存档于2018-06-16).
- . www.accessdata.fda.gov. [April 24, 2019]. (原始内容存档于2020-09-13).
- . April 22, 2019 [April 24, 2019]. (原始内容存档于2019-08-01).
- World Health Organization. . Geneva: World Health Organization. 2021. hdl:10665/345533
 . WHO/MHP/HPS/EML/2021.02.
. WHO/MHP/HPS/EML/2021.02. - . ClinCalc. [October 16, 2021]. (原始内容存档于2020-03-18).
- . ClinCalc. [October 16, 2021]. (原始内容存档于2020-07-08).
- . 7 September 2020 [2022-09-20]. (原始内容存档于2022-09-22).
- Fassiadis N. . Expert Opinion on Pharmacotherapy. December 2009, 10 (18): 2945–2946. PMID 19925048. S2CID 23498967. doi:10.1517/14656560903413559.
- Lowenstern A, Al-Khatib SM, Sharan L, Chatterjee R, Allen LaPointe NM, Shah B, et al. . Annals of Internal Medicine. December 2018, 169 (11): 774–787. PMC 6825839
 . PMID 30383133. doi:10.7326/M18-1523.
. PMID 30383133. doi:10.7326/M18-1523. - Gómez-Outes A, Terleira-Fernández AI, Calvo-Rojas G, Suárez-Gea ML, Vargas-Castrillón E. . Thrombosis. 2013, 2013: 640723. PMC 3885278
 . PMID 24455237. doi:10.1155/2013/640723
. PMID 24455237. doi:10.1155/2013/640723  .
. - Brown DG, Wilkerson EC, Love WE. . Journal of the American Academy of Dermatology. March 2015, 72 (3): 524–34. PMID 25486915. doi:10.1016/j.jaad.2014.10.027.
- . www.nice.org.uk. [January 1, 2020]. (原始内容存档于2020-05-13).
- Sunkara T, Ofori E, Zarubin V, Caughey ME, Gaduputi V, Reddy M. . Health Services Insights. 2016, 9 (Suppl 1): 25–36. PMC 5156547
 . PMID 28008269. doi:10.4137/HSI.S40701.
. PMID 28008269. doi:10.4137/HSI.S40701. - Mueck W, Kubitza D, Becka M. . British Journal of Clinical Pharmacology. September 2013, 76 (3): 455–66. PMC 3769672
 . PMID 23305158. doi:10.1111/bcp.12075.
. PMID 23305158. doi:10.1111/bcp.12075. - (PDF). U.S. Food and Drug Administration. [September 1, 2014]. (原始内容存档 (PDF)于2014-05-02).
- . WebMD. [September 1, 2014]. (原始内容存档于2014-09-03).
- . RxList. [September 1, 2014]. (原始内容存档于2014-09-03).
- Raschi E, Poluzzi E, Koci A, Salvo F, Pariente A, Biselli M, et al. . British Journal of Clinical Pharmacology. August 2015, 80 (2): 285–93. PMC 4541976
 . PMID 25689417. doi:10.1111/bcp.12611.
. PMID 25689417. doi:10.1111/bcp.12611. - Russmann S, Niedrig DF, Budmiger M, Schmidt C, Stieger B, Hürlimann S, Kullak-Ublick GA. (PDF). Journal of Hepatology. August 2014, 61 (2): 293–300 [2022-09-20]. PMID 24681117. doi:10.1016/j.jhep.2014.03.026. (原始内容存档 (PDF)于2018-12-11).
- Schroeder C. . DrugNews. DrugNews. [August 10, 2016]. (原始内容存档于2016-08-11).
- Schroeder C. . DrugNews. [August 20, 2015]. (原始内容存档于2015-05-10).
- Mo Y, Yam FK. . Pharmacotherapy. February 2015, 35 (2): 198–207. PMID 25644580. S2CID 22593448. doi:10.1002/phar.1532.
- (PDF). FDA. [August 1, 2018]. (原始内容存档 (PDF)于2018-07-26).
- . Portola Pharmaceuticals Inc. (GlobeNewswire News Room). [August 1, 2018]. (原始内容存档于2021-04-10).
- Roehrig S, Straub A, Pohlmann J, Lampe T, Pernerstorfer J, Schlemmer KH, et al. . Journal of Medicinal Chemistry. September 2005, 48 (19): 5900–8. PMID 16161994. doi:10.1021/jm050101d.
- Ansell J. . Fourth. Elsevier. January 2019: 747–777. ISBN 978-0-323-46202-0. doi:10.1016/B978-0-323-46202-0.00037-6.
- Berkrot B. . Reuters. December 23, 2015 [2022-09-20]. (原始内容存档于2019-04-03).
- Turpie AG. . European Heart Journal. January 2008, 29 (2): 155–65. PMID 18096568. doi:10.1093/eurheartj/ehm575
 .
. - Eriksson BI, Borris LC, Dahl OE, Haas S, Huisman MV, Kakkar AK, et al. . Circulation. November 2006, 114 (22): 2374–2381. PMID 17116766. doi:10.1161/CIRCULATIONAHA.106.642074
 .
. - Stampfuss J, Kubitza D, Becka M, Mueck W. . International Journal of Clinical Pharmacology and Therapeutics. July 2013, 51 (7): 549–561. PMID 23458226. doi:10.5414/CP201812.
- European Medicines Agency. (PDF). 2008 [June 11, 2009].
- Singh AK, Noronha V, Gupta A, Singh D, Singh P, Singh A, Singh A. . Cancer Res Stat Treat. 2020, 3: 264–269. doi:10.4103/CRST.CRST_122_19.
- (PDF). Bayer AG Communications, Government Relations & Corporate Brand. September 29, 2016 [2022-09-20]. (原始内容存档 (PDF)于2017-01-31).
- (新闻稿). Bayer. September 16, 2008 [January 31, 2010]. (原始内容存档于2011-07-11).
- (新闻稿). Bayer. February 10, 2008 [January 31, 2010]. (原始内容存档于2008-10-22).
- . US Food and Drug Association. November 4, 2011 [April 27, 2016]. (原始内容存档于2011-11-05).
- . washingtonpost.com. [April 7, 2019]. (原始内容存档于2019-03-26).
- Thomas K. . The New York Times. March 1, 2016 [May 3, 2016]. (原始内容存档于2016-03-05).
- Patel V. . The Chronicle. Duke Student Publishing Company. [2022-09-20]. (原始内容存档于2016-05-08).
- Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. . The New England Journal of Medicine. September 2011, 365 (10): 883–91. PMC 3860773
 . PMID 21830957. doi:10.1056/NEJMoa1009638.
. PMID 21830957. doi:10.1056/NEJMoa1009638. - . U.S. Food and Drug Administration. U.S. Food and Drug Administration. [May 3, 2016]. (原始内容存档于2016-05-15).
- Patel MR, Hellkamp AS, Fox KA. (PDF). The New England Journal of Medicine. February 2016, 374 (8): 785–8 [2022-09-20]. PMID 26839968. doi:10.1056/NEJMc1515842. hdl:20.500.11820/69b742f0-5b6d-4f54-93a5-98a1da909653
 . (原始内容存档 (PDF)于2018-07-22).
. (原始内容存档 (PDF)于2018-07-22).