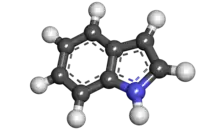
吲哚
| 吲哚 | |
|---|---|
 | |
 | |
| IUPAC名 Indole | |
| 别名 | 2,3-苯并吡咯 |
| 识别 | |
| CAS号 | 120-72-9 |
| PubChem | 798 |
| ChemSpider | 776 |
| SMILES |
|
| InChI |
|
| InChIKey | SIKJAQJRHWYJAI-UHFFFAOYAI |
| ChEBI | 16881 |
| RTECS | NL2450000 |
| KEGG | C00463 |
| 性质 | |
| 化学式 | C₈H₇N |
| 117.15 g·mol⁻¹ | |
| 外观 | 白色固体 |
| 密度 | 1.22 g/cm³,固体 |
| 熔点 | 52至54℃;326 K |
| 沸点 | 253至254℃;526 K |
| 溶解性(水) | 1.9 g/L,20 ℃ 溶于热水 |
| pKa | 16.2 (在DMSO中为21.0) |
| pKb | 17.6 |
| 结构 | |
| 晶体结构 | 未知 |
| 分子构型 | 平面 |
| 偶极矩 | 2.11 D(在苯中) |
| 危险性 | |
| 警示术语 | R:R21/22-R37/38-R41-R50/53 |
| 安全术语 | S:S26-S36/37/39-S60-S61 |
| MSDS | |
| 闪点 | 121℃ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
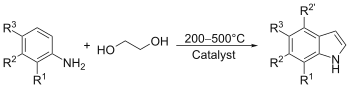
吲哚在室温是固体。吲哚广泛分布于自然环境中,尤其是人类和畜禽粪便中,有强烈粪臭味;但很低浓度的吲哚有像花的香味[1],是橘子花等许多花香的成分,煤焦油也會有吲哚。吲哚也用来制造香水。
很多有机化合物都有吲哚结构,比如色氨酸及含色氨酸的蛋白质,生物碱及色素也有吲哚结构。
吲哚能亲电取代,多取代于3位。取代吲哚是许多色胺碱的基础结构,比如神经传递素复合胺,褪黑素,迷幻药,二甲基色胺,5-甲氧基-二甲基色胺和LSD。其他的吲哚化合物包括植物生长素(吲哚-3-乙酸),抗炎药物消炎痛(茚甲新)和血管舒张药物心得乐。
吲哚首次由混合靛蓝和发烟硫酸制得,英名indole由indigo(靛藍)和oleum(发烟硫酸)组成。
历史

吲哚化学在研究靛青後开始发展,继而转化为研究靛红,然后是羟吲哚。1866年,阿道夫·冯·拜尔用锌粉将羟吲哚还原为了吲哚[2]。1869年,他假设出吲哚的结构,至今仍廣受认可[3]。
直到19世纪末,人们也仅將某些吲哚化合物看成重要染料。20世纪30年代,人们發现吲哚是色氨酸和植物激素等很多重要生物碱的核心基团,对吲哚越來越有兴趣,到现在对吲哚的研究仍然很活跃[4]。
化学反应
亲电取代反应
3位氫最易亲电取代,活性是苯环氫的1013倍。例如Vilsmeier-Haack酰化反应在室温就能于3位碳反应[9]。吡咯环富集电子,往往在1位氮和2、3位碳都取代后,苯环才可能亲电取代。
芦竹碱是由吲哚、二甲胺和甲醛經Mannich反应得到的常用中间体。是3-吲哚乙酸和色氨酸的前体。
氮位氢的酸性和金属有机盐
氮位氢在二甲亞碸中的pKa是21,需要氢化钠或丁基锂等非常强的碱才可能在无水环境将之去质子。其金属盐(非常强碱)有两种存在形式。钾、钠离子难成共价键,负电荷集中在1位氮;镁(包括Grignard试剂)和(尤其是)锌可成共价键,负电荷集中在3位碳。类似,在DMF或DMSO等极性非质子溶剂中,1位氮易受到亲电试剂进攻;而在甲苯等非极性溶剂中,则是3位碳更活泼[10]。
碳位氢的酸性和锂化2位碳
2位碳的氢第二酸。若吲哚衍生物的氮受保护,丁基锂或二异丙基氨基钾就专一將2位碳去质子,得到非常强的亲核试剂。Bergman和Venemalm开发出不保护氮即可取代2位氫的反應[11]。
Alan Katrizky也曾开发出类似技术[12]。
参见
引用
- http://www.leffingwell.com/olfact5.htm
- Baeyer, A. . Ann. 1866, 140 (3): 295. doi:10.1002/jlac.18661400306.
- Baeyer, A.; Emmerling, A. . Chemische Berichte. 1869, 2: 679. doi:10.1002/cber.186900201268.
- R. B. Van Order, H. G. Lindwall. . Chem. Rev. 1942, 30: 69–96. doi:10.1021/cr60095a004.
- Gribble G. W. . J. Chem. Soc. Perkin Trans. 1. 2000, (7): 1045. doi:10.1039/a909834h.
- Cacchi, S.; Fabrizi, G. . Chem. Rev. 2005, 105 (7): 2873. PMID 16011327. doi:10.1021/cr040639b.
- Humphrey, G. R.; Kuethe, J. T. . Chem. Rev. 2006, 106 (7): 2875. PMID 16836303. doi:10.1021/cr0505270.
- Gerd Collin and Hartmut Höke “Indole” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a14_167.
- James, P. N.; Snyder, H. R. . Organic Syntheses. 1959, 39: 30 [2011-06-27]. (原始内容存档于2012-10-02).
- Heaney, H.; Ley, S. V. . Organic Syntheses. 1974, 54: 58 [2011-06-27]. (原始内容存档于2012-10-02).
- Bergman, J.; Venemalm, L. . J. Org. Chem. 1992, 57 (8): 2495. doi:10.1021/jo00034a058.
- Alan R. Katritzky, Jianqing Li, Christian V. Stevens. . J. Org. Chem. 1995, 60 (11): 3401–3404 [2011-06-27]. doi:10.1021/jo00116a026. (原始内容存档于2020-03-16).
- Lynch, S. M. ; Bur, S. K.; Padwa, A. . Org. Lett. 2002, 4 (26): 4643. PMID 12489950. doi:10.1021/ol027024q.
外部链接
| 维基共享资源上的相关多媒体资源:吲哚 |
- Synthesis of indoles (overview of recent methods)(页面存档备份,存于)
- Synthesis and propierties of indoles(页面存档备份,存于) at chemsynthesis.com
.svg.png.webp)