克脑文盖尔缩合反应
Knoevenagel缩合反应(爾文格反應;克諾維那蓋爾縮合反應;柯諾瓦諾格反應;克爾文蓋爾縮合反應),又稱Knoevenagel反應
| 克脑文盖尔缩合反应 | |
|---|---|
| 命名根据 | 克脑文盖尔 |
| 反应类型 | 偶联反应 |
| 标识 | |
| 有机化学网站对应网页 | 克脑文盖尔缩合 |
| RSC序号 | RXNO:0000044 |
含有活潑亞甲基的化合物與醛或酮在弱鹼催化下,發生失水縮合生成α,β-不飽和羰基化合物及其類似物。
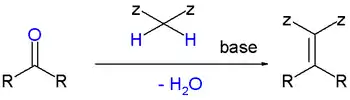
Z 基是吸電子基團,一般為 CHO、COR、COOR、COOH、CN、NO2 等基團。兩個 Z 基可以相同,也可以不同。NO2 的吸電子能力很強,有一個就足以產生活潑氫。
常用的催化劑有哌啶、吡啶、喹啉和其他一級胺、二級胺等。常用的活潑亞甲基化合物有丙二酸二乙酯、米氏酸、乙醯乙酸乙酯、硝基甲烷和丙二酸等,但事實上任何含有能被鹼除去氫原子的 C-H 鍵化合物都能發生此反應。
Knoevenagel 反應是對Perkin反應的改進,活潑亞甲基化合物的存在,使得弱鹼作用下,就能產生足夠濃度的碳負離子進行親核加成。弱鹼的使用避免了醛酮的自身縮合,因此除芳香醛外,酮和脂肪醛均能進行反應,擴大了適用範圍。
Knoevenagel 反應是製備 α,β-不飽和化合物的常用方法之一。
历史
这个反应最早是由德国化学家亚瑟·汉斯发现的,1885年,他用乙酰乙酸乙酯、苯甲醛和氨反应,发现生成了对称的缩合产物 2,6-二甲基-4-苯基-1,4-二氢吡啶-3,5-二甲酸二乙酯,也生成了少量的 2,4-二乙酰基-3-苯基戊二酸二乙酯,这是有关 Knoevenagel 反应的最早纪录。[1][2][3]
1894年,德国化学家 Emil Knoevenagel 从多个方面对这一反应作了进一步研究,他发现任何一级和二级胺都可以促进反应进行;反应可以分步进行;而且丙二酸酯可以代替乙酰乙酸乙酯作为活性的亚甲基化合物。[4][5]
两年之后,Knoevenagel 又开始了对这个反应的研究,他发现,在室温或 0 °C 时,苯甲醛与过量乙酰乙酸乙酯在催化量的哌啶作用下,会生成双加成物 2,4-二乙酰基-3-苯基戊二酸二乙酯。他的一个助手重复了这个实验,在冷却一步上消耗了更少的时间,结果发现得到的产物与之前的产物不同,这次的产物是缩合产物苄叉乙酰乙酸乙酯与上述双加成物的混合物。进一步的研究又发现,如果使用等摩尔的苯甲醛和乙酰乙酸乙酯,将反应温度控制在 0 °C,那么两者之间的反应便可以定量生成缩合产物苄叉乙酰乙酸乙酯,而基本上不产生加成物。[6] 这便是现今所看到的 Knoevenagel 反应的雏形,缩合产物苄叉(或烷叉)乙酰乙酸乙酯也被称为 Knoevenagel 产物。但实际上,Claisen 等早在十余年前就已经通过其他方法得到该类型的化合物了,[7][8] 只不过 Knoevenagel 所用的方法和条件更温和一些而已。
此后的研究表明,如果用原始反应条件处理苄叉乙酰乙酸乙酯,又可得到双加成物,从而证实了苄叉乙酰乙酸乙酯是双加成物生成过程中的中间产物。
反应机理
Knoevenagel 是由碱催化的缩合反应,类似于羟醛反应。根据所用碱种类的不同,可以有两种可行的机理。一种是认为醛或酮先与胺缩合为亚胺,然后再与碳负离子加成。
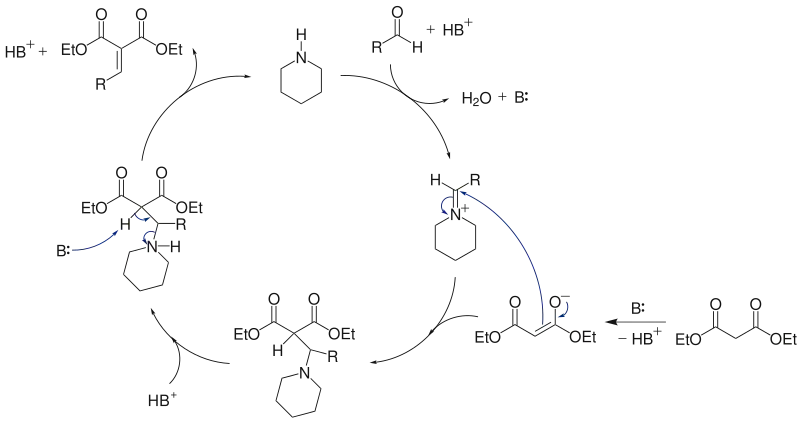
这个机理与 Knoevenagel 最初提出的机理(下图)有些类似。在 Knoevenagel 发现这个反应之前,就已知苯甲醛可以与两分子的哌啶缩合,生成苄叉二哌啶缩氨醛。而且苄叉二哌啶缩氨醛与乙酰乙酸乙酯在乙醇中作用时,可以高产率得到下图中的最终产物双加成物。[9] 因此 Knoevenagel 认为,反应的机理应是胺与醛先缩合为缩氨醛,受乙酰乙酸乙酯进攻,产生 β-氨基二羰基化合物中间产物,然后消除哌啶得到 α,β-不饱和羰基化合物,并最后与另一分子乙酰乙酸乙酯进行Michael加成,得最终的双加成产物。
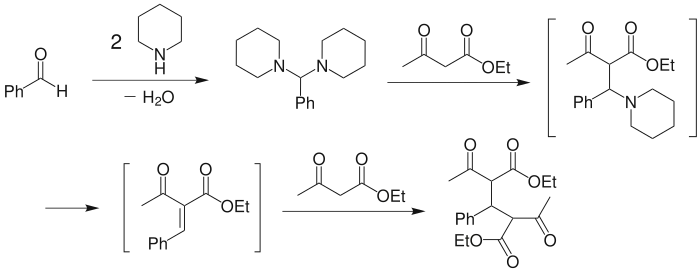
另一种机理(Hann–Lapworth 机理)则认为,首先是丙二酸二乙酯与醛在碱作用下羟醛加成为 β-羟基二羰基化合物中间产物,然后再消除水得到缩合产物。
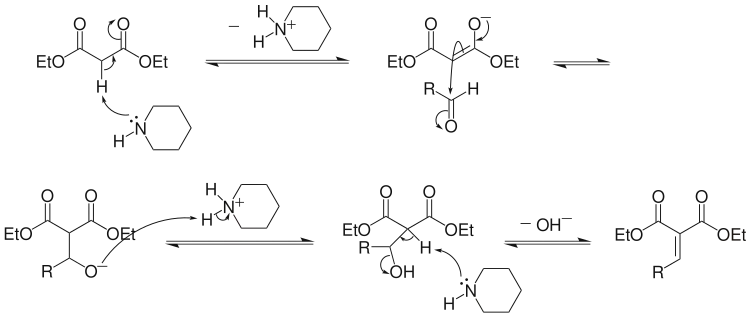
上述两种机理中的中间产物 β-氨基二羰基化合物[10] 和 β-羟基二羰基化合物[11] 都已从不同的反应中分离出来。一般认为,当反应用碱为三级胺时,Hann–Lapworth 机理占主导地位;而当反应用碱为一级或二级胺时,两种机理都有可能发生。
改进法
Doebner改进法,又称Verley–Doebner改进法
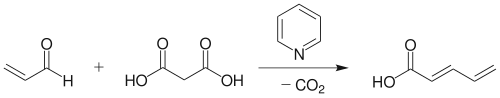
用丙二酸或丙二酸酯作原料时,反应产生的烷叉丙二酸(酯),(经水解)可在吡啶作用下继续脱去一个羧基,生成单羧酸。[12] 例如,丙烯醛与丙二酸在吡啶中反应,可得脱羧产物反式-2,4-戊二烯酸。[13]
应用
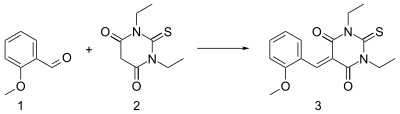
1、2-甲氧基苯甲醛与二乙基硫代巴比妥酸在乙醇中发生 Knoevenagel 反应,以哌啶作碱,可得电荷转移络合物 (3)。[14]
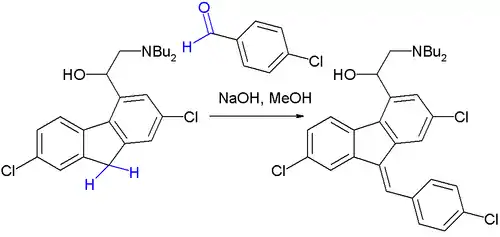
2、抗疟疾药物本芴醇(lumefantrine)制取中的最后一步。[15] 反应最初产物是 E/Z 异构体的 50:50 混合物,但最终会转化为热力学上更稳定的 Z 型异构体。
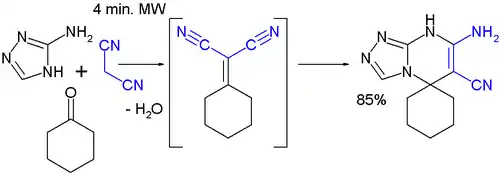
3、微波促进的环己酮、丙二腈和3-氨基-1,2,4-三唑之间发生的多组分反应。[16]
参考资料
- Dr. Arthur Hantzsch. . Justus Liebigs Ann. Chem. 1882, 215 (1): 1–82. doi:10.1002/jlac.18822150102.
- A. Hantzsch. . Ber. Dtsch. Chem. Ges. 1883, 16 (2): 1946–1948. doi:10.1002/cber.18830160282.
- A. Hantzsch. . Ber. Dtsch. Chem. Ges. 1885, 18 (2): 2579–2586. doi:10.1002/cber.188501802158.
- E. Knoevenagel. . Justus Liebigs Ann. Chem. 1894, 281 (1): 25–126. doi:10.1002/jlac.18942810104.
- E. Knoevenagel. . Ber. Dtsch. Chem. Ges. 1894, 27 (2): 2345–2346. doi:10.1002/cber.189402702229.
- E. Knoevenagel. . Ber. Dtsch. Chem. Ges. 1896, 29 (1): 172–174. doi:10.1002/cber.18960290133.
- L. Claisen. . Ber. Dtsch. Chem. Ges. 1881, 14 (1): 345–349. doi:10.1002/cber.18810140181.
- L. Claisen, L. Crismer. . Justus Liebigs Ann. Chem.: 129–144. doi:10.1002/jlac.18832180203.
- Emil Knoevenagel. . Ber. Dtsch. Chem. Ges. 1898, 31: 2596–2619. doi:10.1002/cber.18980310308.
- Rikuhei Tanikaga, Tadashi Tamura, Yoshihito Nozaki and Aritsune Kaji. . J. Chem. Soc., Chem. Commun. 1984, (2): 87–88. doi:10.1039/C39840000087.
- Genji Iwasaki, Seitaro Saeki and Masatomo Hamana. . Chem. Lett. 1986, 15 (2): 173–176. doi:10.1246/cl.1986.173.
- O. Doebner. . Ber. Dtsch. Chem. Ges. 1902, 35: 1136–1136. doi:10.1002/cber.190203501187.
- Peter J. Jessup, C. Bruce Petty, Jan Roos, and Larry E. Overman (1988). "1-N-Acylamino-1,3-dienes from 2,4-pentadienoic acids by the curtius rearrangement: benzyl trans-1,3-butadiene-1-carbamate". Org. Synth.; Coll. Vol. 6: 95.
- Abdullah Mohamed Asiria, Khaled Ahmed Alamrya Abraham F. Jalboutb, Suhong Zhang. . Molbank. 2004: M359 [2009-09-11]. (原始内容存档于2011-07-09).
- Ulrich Beutler, Peter C. Fuenfschilling, and Andreas Steinkemper. . Org. Process Res. Dev. 2007, 11 (3): 341–345. doi:10.1021/op060244p.
- Anshu Dandia, Pritima Sarawgi, Kapil Arya, and Sarita Khaturia. (PDF). Arkivoc. 2007, (06-2251BP): 83–92 [2009-09-11]. (原始内容 (PDF)存档于2007-09-29).