特伯试剂
特伯试剂是化学式为(C5H5)2TiCH2ClAl(CH3)2的有机金属化合物,被用于羰基的亚甲基化反应[1]。特伯试剂是红色固体,在空气中会自燃,因此需要在无空气体系中使用。由杜邦中央研究院的弗雷德里克·奈·特伯最早合成,并由此得名。
| 特伯试剂 | |
|---|---|
 | |
 | |
| IUPAC名 μ-Chloro[di(cyclopenta-2,4-dien-1-yl)]dimethyl(μ-methylene)titaniumaluminum | |
| 识别 | |
| CAS号 | 67719-69-1 |
| PubChem | 53384502 |
| ChemSpider | 34981139 |
| SMILES |
|
| InChI |
|
| InChIKey | FHPQZKBPAZOMGO-SBUAZLESAR |
| 性质 | |
| 化学式 | C13H18AlClTi |
| 284.60 g·mol⁻¹ | |
| 溶解性(有机溶剂) | 甲苯、苯、二氯甲烷、 THF (仅在低温时) |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
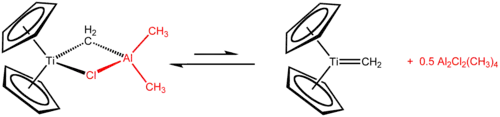
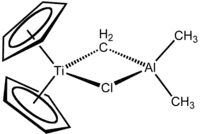
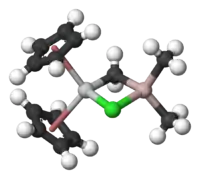
特伯试剂包含一对桥连配体连接的两个四面体金属中心,钛上有两个环戊二烯基([C
5H
5]−
),铝上有两个甲基。钛和铝通过亞甲基桥(-CH2-)和氯原子以四边形的(Ti–CH2–Al–Cl)几何结构相连[2]。特伯试剂是第一个被报告的由亚甲基桥连过渡金属和主族金属的化合物[3]。
制备
特伯试剂可以由二氯二茂钛和三甲基铝在甲苯中合成[3][4]:
- Cp2TiCl2 + 2 Al(CH3)3 → CH4 + Cp2TiCH2AlCl(CH3)2 + Al(CH3)2Cl
反应约三天后,重结晶去除Al(CH3)2Cl [3]后得到产物。尽管使用分离的特伯试剂进行有机合成会得到更纯净的产物,但特伯试剂的原位合成也已经被报道[5][6],仅需要在加入起始原料前将溶液放在冰浴或干冰浴中即可。
另一种更麻烦的可选合成方法是是使用二甲基二茂钛(Petasis试剂)来合成[7]:
- Cp2Ti(CH3)2 + Al(CH3)2Cl → Cp2TiCH2AlCl(CH3)2 + CH4
该反应不仅需要复杂的原料,而且还难以将产物分离。
反应机理
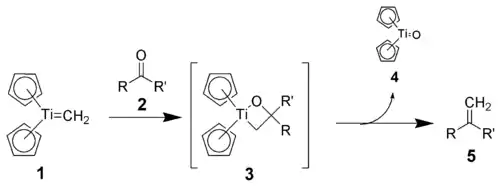
特伯试剂不会直接与羰基反应,必须先使用温和的路易斯碱处理(如吡啶)得到活性的Schrock卡宾。
类似于威悌试剂,反应可能是Ti (IV)的亲氧性驱动的。Schrock卡宾(1)与羰基化合物(2)反应生成推测的四元环中间体(3),这一中间体从未被分离,因为它会立刻分解为对应的烯烃(5)。
应用
特伯试剂可以用于有机合成中的羰基亚甲基化[8][9][10],这一操作同样可以用威悌试剂实现,但特伯试剂对空间位阻羰基更有效。此外,特伯试剂碱性更弱,不会产生β-消除产物。
特伯试剂可以将醛、内酯、酰胺亚甲基化,将酯变为对应的烯醇醚,将酰胺变为对应的烯胺。在同时含有酯和酮的化合物中,特伯试剂可以选择性地还原酮羰基[11],但邻近基团的空间位阻也会影响反应的选择性。
特伯试剂的亚甲基化反应不会将手性α-C外消旋,从而得以保持其立体化学构型,因此在糖类化合物的反应中有重要作用[12]。
特伯试剂可以与酰氯反应,取代氯得到烯醇钛化合物。
参考文献
- F. N. Tebbe, G. W. Parshall and G. S. Reddy. . J. Am. Chem. Soc. 1978, 100 (11): 3611–3613. doi:10.1021/ja00479a061.
- Thompson, Rick; Nakamaru-Ogiso, Eiko; Chen, Chun-Hsing; Pink, Maren; Mindiola, Daniel J. . Organometallics. 2014, 33 (1): 429–432. doi:10.1021/om401108b.
- Herrmann, W.A., "The Methylene Bridge" Advances in Organometallic Chemistry 1982, 20, 195–197.
- Straus, D. A., "μ-Chlorobis(cyclopentadienyl)(dimethylaluminium)-μ-methylenetitanium": Encyclopedia of Reagents for Organic Synthesis. John Wiley, London, 2000.
- Pine, S. H.; Kim, V.; Lee, V. . Org. Synth. 1990, 69: 72. doi:10.15227/orgsyn.069.0072.
- L. F. Cannizzo; R. H. Grubbs. . J. Org. Chem. 1985, 50 (13): 2386–2387. doi:10.1021/jo00213a040.
- Payack, J. F.; Hughes, D. L.; Cai, D.; Cottrell, I. F.; Verhoeven, T. R. (2004). "Dimethyltitanocene". Org. Synth.; Coll. Vol. 10: 355.
- Hartley, Richard C.; Li, Jianfeng; Main, Calver A.; McKiernan, Gordon J. . Tetrahedron. 2007, 63 (23): 4825–4864. doi:10.1016/j.tet.2007.03.015.
- Pine, S. H. Org. React. 1993, 43, 1. (Review)
- Beadham, I.; Micklefield, J. Curr. Org. Synth. 2005, 2, 231–250. (Review)
- Bunch, L; Liljefors, T; Greenwood, J. R; Frydenvang, K; Brauner-Osborne, H.; Krogsgaard-Larsen, P.; Madsen, U. 68: 1489. 2003. doi:10.1021/jo026509p.
- A. Marra, J. Esnault, A. Veyrieres and P. Sinay. . J. Am. Chem. Soc. 1992, 114 (16): 6354–6360. doi:10.1021/ja00042a010.
- Luciano Lombardo. . Organic Syntheses. 1987, 65: 81. doi:10.15227/orgsyn.065.0081..