亚硝酰氟
| 亚硝酰氟 | |
|---|---|
 | |
 | |
| IUPAC名 Nitrosyl fluoride | |
| 别名 | 亚硝基氟 氟氧化氮 |
| 识别 | |
| 缩写 | NOF |
| CAS号 | 7789-25-5 |
| PubChem | 123261 |
| ChemSpider | 109874 |
| SMILES |
|
| EINECS | 232-153-6 |
| 性质 | |
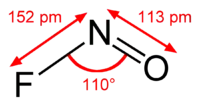
| 化学式 | NOF |
| 49.0045 g·mol⁻¹ | |
| 外观 | 无色气体 含杂质时为蓝色 |
| 密度 | 1.719 g/cm3 (固) 1.326 g/mL (液) 2.657 g/L (气) |
| 熔点 | -166°C (107.15 K) |
| 沸点 | -72.4°C (200.75 K) |
| 溶解性(水) | 反应 |
| 相关物质 | |
| 其他阴离子 | 亚硝酰氯、亚硝酰溴 |
| 其他阳离子 | 硝酰氟、亚硫酰氟 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制法
- 氟与一氧化氮直接反应:
- 2 NO + F2 → 2 NOF
- NO + AgF2 → NOF + AgF
- N2O4 + CsF → NOF + CsNO3[1]
- 用纯净的氟硼酸亚硝酰与干燥的氟化钠反应在300°C下反应:
- NOBF4 + NaF → NaBF4 + NOF
反应
NOF是一种十分活泼的氟化剂,能将多种金属转化为它们的氟化物,并释放出一氧化氮:
- n NOF + M → MFn + n NO
NOF也能与路易斯酸反应产生类似于盐的加合物,例如NOBF4和(NO)2XeF8。
-78°C的真空条件下,亚硝酰氟能与一氟化氯形成加合物:
- NOF + ClF → NO+ClF2-
产物是白色固体,在-110°C以下稳定,一旦受热又分解成原来的反应物。类似加合物还有NO+ClF4-,它比NO+ClF2-略稳定。[1]
亚硝酰氟的水溶液能溶解金属,其作用机理与王水类似。亚硝酰氟先与水反应产生亚硝酸和氢氟酸,然后亚硝酸歧化分解产生硝酸和一氧化氮:
- NOF + H2O → HNO2 + HF
- 3 HNO2 → HNO3 + 2 NO + H2O
- ROH + NOF → RONO + HF
参考资料
- 张青莲. . 北京: 科学出版社. : P162–163. ISBN 7-03-002238-6.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
外部链接
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.