硫酸乙酰肝素
硫酸乙酰肝素(,可缩写为HS),是一种广泛存在于各种动物组织中细胞外基质的链状多糖[1]。在生物体中硫酸乙酰肝素一般以蛋白聚糖的形式存在,往往会有两条或三条硫酸乙酰肝素链与细胞表面或细胞外基质蛋白质结合[2][3]。因此,硫酸乙酰肝素能够与包括Wnt家族蛋白在内的多种蛋白配体结合[4][5][6]并由此调节包括发育、血管生成、血液凝固、经GrB(Granzyme B)介导抑制细胞脱落活性以及肿瘤转移等多种生物学过程[7]。一些研究表明,硫酸乙酰肝素还可以作为呼吸道合胞病毒等病毒的细胞受体[8]。一项研究表明,在SARS-CoV-2(新冠病毒)感染过程中,冠状病毒刺突蛋白会同时与硫酸乙酰肝素和血管紧张素转化酶2分子结合[9]。
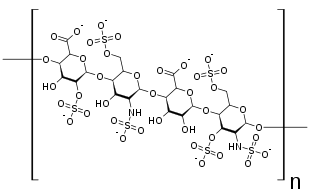
蛋白聚糖形式
细胞膜上的硫酸乙酰肝素一般与Syndecan以及由糖磷脂酰肌醇锚定的Glypican结合形成蛋白聚糖[10][6]。不过,硫酸乙酰肝素链也可以与CD44蛋白的V3剪接异构体结合(这种情况主要存在于角质细胞和活化的单核细胞中)[11]或TGFBR3蛋白结合形成蛋白聚糖[12]。
细胞质基质中的硫酸乙酰肝素则一般与Fractone[13]、多结构域的Perlecan[14]、聚集蛋白[15]、COL18A1[16]蛋白等核心蛋白结合形成蛋白聚糖。
结构
硫酸乙酰肝素是一种糖胺聚糖,其结构与肝素非常相似。不过,硫酸乙酰肝素中最常见的二糖单位由葡萄糖醛酸(GlcA)和N-乙酰葡萄糖胺(GlcNAc)组成,通常约占总二糖单位的50%左右。相比之下,肝素中的IdoA(2S)-GlcNS(6S)二糖单位在牛肺肝素中占85%,在猪肠黏膜肝素中约占75%。在定义同时含有“肝素样”和“硫酸乙酰肝素样”结构的混合性糖胺聚糖时会出现问题。一种看法是只有当N-硫酸酯基团的含量大大超过N-乙酰基团的含量,并且O-硫酸酯基团的密度超过N-硫酸酯基团时,一种糖胺聚糖才能被归为肝素,反之则应归为硫酸乙酰肝素[17]。在生理条件下,硫酸乙酰肝素中的酯基和酰胺硫酸酯基团会去质子化,并吸引正电荷对离子形成盐。一般认为,肝素硫酸酯在细胞表面以这种形式存在[18]。
以下仅列出常见的硫酸乙酰肝素二糖单位,而较少见如包含3-O-硫酸化的葡萄糖胺(GlcNS(3S,6S))或自由胺基(GlcNH3+)的二糖单位则未列出。
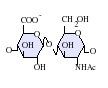 GlcA-GlcNAc
GlcA-GlcNAc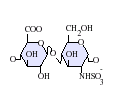 GlcA-GlcNS
GlcA-GlcNS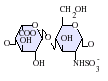 IdoA-GlcNS
IdoA-GlcNS-GlcNS.png.webp) IdoA(2S)-GlcNS
IdoA(2S)-GlcNS.png.webp) IdoA-GlcNS(6S)
IdoA-GlcNS(6S)-GlcNS(6S).png.webp) IdoA(2S)-GlcNS(6S)
IdoA(2S)-GlcNS(6S)
缩写
- GlcA = β-D-葡萄糖醛酸
- IdoA = α-L-异尿酸
- IdoA(2S) = 2-O-磺酸基-α-L-异尿酸
- GlcNAc = 2-脱氧-2-乙酰胺基-α-D-葡萄糖吡喃糖
- GlcNS = 2-脱氧-2-磺酰胺基-α-D-葡萄糖吡喃糖
- GlcNS(6S) = 2-脱氧-2-磺酰胺基-α-D-葡萄糖吡喃糖-6-O-硫酸酯
生物合成
不同的细胞合成的硫酸乙酰肝素链往往是不同的。虽然硫酸乙酰肝素的生物合成主要依赖糖基转移酶、硫酸基转移酶和差向异构酶等一系列酶,但合成硫酸乙酰肝素链的具体方式很大变数。有学者因此提出了“肝素组”()的概念,即特定细胞、组织或生物体产生的肝素结构的集合[19]。
20世纪80年代,杰弗里·埃斯科(Jeffrey Esko)首次分离并研究了与硫酸乙酰肝素生物合成过程相关的突变动物细胞。目前与硫酸乙酰肝素合成相关的许多酶现已得到纯化、分子克隆,表达模式也得到了研究[20]。通过这些研究以及一些使用无细胞系统对肝素以及硫酸乙酰肝素链的生物合成进行的早期工作,现在对与硫酸乙酰肝素生物合成中涉及的酶反应的顺序和特异性已经有了较为深入的了解[21]。
起始与延伸

硫酸乙酰肝素生物合成的第一步是木糖基转移酶(XT)将UDP-木糖分子上的木糖基团经O-连接糖基化与核心蛋白的丝氨酸残基相连。之后,两个半乳糖(Gal)基团经半乳糖基转移酶I和II(GalTI和GalTII)以及一个葡萄糖醛酸残基经由葡萄糖醛酸基转移酶I(GlcATI)分别被添加到新生成的糖链上,形成以下结构[22]:
βGlcUA-(1→3)-βGal-(1→3)-βGal-(1→4)-βXyl-O-Ser
这种常见的四糖连接结构是硫酸乙酰肝素/肝素、硫酸软骨素(CS)和硫酸皮肤素(DS)的生物合成共通步骤,但之后这些分子的合成途径各不相同。β-1,2-N-乙酰氨基葡萄糖轉移酶I(GlcNAcT-I)会主导硫酸乙酰肝素/肝素糖链的合成,而N-乙酰氨基半乳糖转移酶I(GalNAcT-I)则会主导硫酸软骨素与硫酸皮肤素的合成[23]。
一般认为,木糖与核心蛋白质的连接被认为发生在内质网(ER),连接区域和链的其余部分的组装则发生在高尔基体[22][23]。
在四糖连接结构合成之后,葡萄糖醛酸残基与乙酰葡萄糖胺会轮流插入糖链的末端,肝素链由此不断延长。具有糖基转移酶活性EXT基因家族下的蛋白参与肝素链合成过程[22]。EXT1-3上的基因突变会造成肝素链无法合成,使人患上遗传性多发性外生骨疣(MHE),一种影响青少年长骨发育的软骨瘤[24]。
修饰
硫酸乙酰肝素与肝素合成上的主要不同是硫酸基转移酶和差向异构酶会对硫酸乙酰肝素进行修饰,加上来自3'-磷酸腺苷-5'-磷酸硫酸盐(PAPS)的硫酸基团[25][26]。
硫酸乙酰肝素的修饰过程中,首先,经由四种2-脱氧-2-乙酰胺基-α-D-葡萄糖吡喃糖(GlcNAc)N-脱乙酰化酶/N-磺基转移酶(NDSTs)中的一种或多种酶的催化,GlcNAc残基会经历氮端(N-端)的脱乙酰化与硫化,转变为 2-脱氧-2-硫磺胺基-α-D-葡萄糖吡喃糖(GlcNS)。四种NDST都能进行氮端脱乙酰化与氮端磺基转移,但是活性各有不同。这一步对硫酸乙酰肝素的后续修饰而言是必不可少的。这一修饰过程是随机发生的,也就是说肝素链上的所有GlcNAc的N-端都有一定几率被脱乙酰化与硫化[27][28]。
上述的GlcNAc氮端脱乙酰化酶以及氮端磺基转移过程是由同一种酶完成的,但是一些物种中也发现了两种过程的解偶联现象,在硫酸乙酰肝素中发现了2-脱氧-2-氨基-α-D-葡萄糖吡喃糖(GlcNH2)残基的存在[29]。
最后,硫酸乙酰肝素还会发生与2、3,以及6号位碳原子上的O-硫酸基化[30][31]。其中,3号位碳原子的O-硫酸基化可能与癌症发生过程中Wnt信号通路的调节相关[6]。
配体
硫酸乙酰肝素能与许多蛋白发生相互作用,包括细胞外基质的组成蛋白、酶、凝血因子,以及大多数生长因子、细胞因子、趋化因子和成形素[32]。
类似物
硫酸乙酰肝素类似物是指具有与硫酸乙酰肝素相同的性质,但是在创口等蛋白水解环境下依然能保持稳定的物质[34][35]。在创口等炎性环境下,硫酸乙酰肝素会逐渐被肝素酶等酶水解,但硫酸乙酰肝素类似物却能保持稳定,因此有助于伤口恢复等过程[36]。另外,硫酸乙酰肝素类似物因比较稳定,也能在体外用于研究肝素链与蛋白之间的相互作用[37]。
参见
参考文献
- Medeiros GF, Mendes A, Castro RA, Baú EC, Nader HB, Dietrich CP. . Biochimica et Biophysica Acta (BBA) - General Subjects. July 2000, 1475 (3): 287–94. PMID 10913828. doi:10.1016/S0304-4165(00)00079-9.
- Gallagher JT, Lyon M. . Iozzo MV (编).
 . New York, New York: Marcel Dekker Inc. 2000: 27–59.
. New York, New York: Marcel Dekker Inc. 2000: 27–59. - Iozzo RV. . Annual Review of Biochemistry. 1998, 67: 609–52. PMID 9759499. S2CID 14638091. doi:10.1146/annurev.biochem.67.1.609
 .
. - Gao W, Kim H, Feng M, Phung Y, Xavier CP, Rubin JS, Ho M. . Hepatology. August 2014, 60 (2): 576–87. PMC 4083010
 . PMID 24492943. doi:10.1002/hep.26996.
. PMID 24492943. doi:10.1002/hep.26996. - Gao W, Xu Y, Liu J, Ho M. . Scientific Reports. May 2016, 6: 26245. Bibcode:2016NatSR...626245G. PMC 4869111
 . PMID 27185050. doi:10.1038/srep26245.
. PMID 27185050. doi:10.1038/srep26245. - Li N, Gao W, Zhang YF, Ho M. . Trends in Cancer. November 2018, 4 (11): 741–754. PMC 6209326
 . PMID 30352677. doi:10.1016/j.trecan.2018.09.004.
. PMID 30352677. doi:10.1016/j.trecan.2018.09.004. - Buzza MS, Zamurs L, Sun J, Bird CH, Smith AI, Trapani JA, et al. . The Journal of Biological Chemistry. June 2005, 280 (25): 23549–58. PMID 15843372. doi:10.1074/jbc.M412001200
 .
. - Hallak LK, Spillmann D, Collins PL, Peeples ME. . Journal of Virology. November 2000, 74 (22): 10508–13. PMC 110925
 . PMID 11044095. doi:10.1128/JVI.74.22.10508-10513.2000.
. PMID 11044095. doi:10.1128/JVI.74.22.10508-10513.2000. - Clausen TM, Sandoval DR, Spliid CB, Pihl J, Perrett HR, Painter CD, et al. . The Journal of Cell. 14 September 2020, 183 (4): 1043–1057.e15. PMC 7489987
 . PMID 32970989. doi:10.1016/j.cell.2020.09.033.
. PMID 32970989. doi:10.1016/j.cell.2020.09.033. - Ho M, Kim H. . European Journal of Cancer. February 2011, 47 (3): 333–8. PMC 3031711
 . PMID 21112773. doi:10.1016/j.ejca.2010.10.024.
. PMID 21112773. doi:10.1016/j.ejca.2010.10.024. - Jackson DG, Bell JI, Dickinson R, Timans J, Shields J, Whittle N. . The Journal of Cell Biology. February 1995, 128 (4): 673–85. PMC 2199896
 . PMID 7532175. doi:10.1083/jcb.128.4.673.
. PMID 7532175. doi:10.1083/jcb.128.4.673. - Andres JL, DeFalcis D, Noda M, Massagué J. . The Journal of Biological Chemistry. March 1992, 267 (9): 5927–30. PMID 1556106. doi:10.1016/S0021-9258(18)42643-9
 .
. - Mercier, Frederic. . Cell and Molecular Life Sciences. 2016, 73 (24): 4661–4674. PMID 27475964. S2CID 28119663. doi:10.1007/s00018-016-2314-y.
- Arikawa-Hirasawa E, Wilcox WR, Le AH, Silverman N, Govindraj P, Hassell JR, Yamada Y. . Nature Genetics. April 2001, 27 (4): 431–4. PMID 11279527. S2CID 22934192. doi:10.1038/86941.
- Verbeek, Marcel M.; Otte-Höller, Irene; van den Born, Jacob; van den Heuvel, Lambert P.W.J.; David, Guido; Wesseling, Pieter; de Waal, Robert M.W. . The American Journal of Pathology (Elsevier BV). 1999, 155 (6): 2115–2125. ISSN 0002-9440. doi:10.1016/s0002-9440(10)65529-0.
- Kawashima, Hiroto; Watanabe, Norifumi; Hirose, Mayumi; Sun, Xin; Atarashi, Kazuyuki; Kimura, Tetsuya; Shikata, Kenichi; Matsuda, Mitsuhiro; Ogawa, Daisuke; Heljasvaara, Ritva; Rehn, Marko; Pihlajaniemi, Taina; Miyasaka, Masayuki. . Journal of Biological Chemistry (Elsevier BV). 2003, 278 (15): 13069–13076. ISSN 0021-9258. doi:10.1074/jbc.m212244200.
- Gallagher JT, Walker A. . The Biochemical Journal. September 1985, 230 (3): 665–74. PMC 1152670
 . PMID 2933029. doi:10.1042/bj2300665.
. PMID 2933029. doi:10.1042/bj2300665. - LA, Fransson; I, Silverberg; I, Carlstedt. . The Journal of biological chemistry (J Biol Chem). [2023-06-20]. ISSN 0021-9258. PMID 2932448. (原始内容存档于2023-06-20).
- Turnbull J, Powell A, Guimond S. . Trends in Cell Biology. February 2001, 11 (2): 75–82. PMID 11166215. doi:10.1016/s0962-8924(00)01897-3.
- Esko JD, Stewart TE, Taylor WH. . Proceedings of the National Academy of Sciences of the United States of America. May 1985, 82 (10): 3197–201. Bibcode:1985PNAS...82.3197E. PMC 397742
 . PMID 3858816. doi:10.1073/pnas.82.10.3197
. PMID 3858816. doi:10.1073/pnas.82.10.3197  .
. - Lindahl U, Kusche-Gullberg M, Kjellén L. . The Journal of Biological Chemistry. September 1998, 273 (39): 24979–82. PMID 9737951. doi:10.1074/jbc.273.39.24979
 .
. - Kreuger, Johan; Kjellén, Lena. . Journal of Histochemistry & Cytochemistry (SAGE Publications). 2012-10-04, 60 (12): 898–907. ISSN 0022-1554. doi:10.1369/0022155412464972.
- Jones, Courtney L.; Liu, Jian; Xu, Ding. . . Elsevier. 2010: 407–427. doi:10.1016/b978-008045382-8.00132-5.
- Busse-Wicher, Marta; Wicher, Krzysztof B.; Kusche-Gullberg, Marion. . Matrix Biology (Elsevier BV). 2014, 35: 25–33. ISSN 0945-053X. doi:10.1016/j.matbio.2013.10.001.
- Silbert JE. . The Journal of Biological Chemistry. November 1967, 242 (21): 5146–52. PMID 4228675. doi:10.1016/S0021-9258(18)99487-1
 .
. - Carlsson P, Presto J, Spillmann D, Lindahl U, Kjellén L. . The Journal of Biological Chemistry. July 2008, 283 (29): 20008–14. PMID 18487608. doi:10.1074/jbc.M801652200
 .
. - Höök M, Lindahl U, Hallén A, Bäckström G. . The Journal of Biological Chemistry. August 1975, 250 (15): 6065–71. PMID 807579. doi:10.1016/S0021-9258(19)41159-9
 .
. - Aikawa J, Grobe K, Tsujimoto M, Esko JD. . The Journal of Biological Chemistry. February 2001, 276 (8): 5876–82. PMID 11087757. doi:10.1074/jbc.M009606200
 .
. - Toida T, Yoshida H, Toyoda H, Koshiishi I, Imanari T, Hileman RE, et al. . The Biochemical Journal. March 1997,. 322 ( Pt 2) (Pt 2): 499–506. PMC 1218218
 . PMID 9065769. doi:10.1042/bj3220499.
. PMID 9065769. doi:10.1042/bj3220499. - Shukla D, Liu J, Blaiklock P, Shworak NW, Bai X, Esko JD, et al. . Cell. October 1999, 99 (1): 13–22. PMID 10520990. S2CID 14139940. doi:10.1016/s0092-8674(00)80058-6
 .
. - Xia G, Chen J, Tiwari V, Ju W, Li JP, Malmstrom A, et al. . The Journal of Biological Chemistry. October 2002, 277 (40): 37912–9. PMID 12138164. doi:10.1074/jbc.m204209200
 .
. - Ori A, Wilkinson MC, Fernig DG. . Frontiers in Bioscience. May 2008, 13 (13): 4309–38 [2023-06-29]. PMID 18508513. doi:10.2741/3007. (原始内容存档于2022-09-10).
- Sadir R, Forest E, Lortat-Jacob H. . The Journal of Biological Chemistry. May 1998, 273 (18): 10919–25. PMID 9556569. doi:10.1074/jbc.273.18.10919
 .
. - Tong M, Tuk B, Hekking IM, Vermeij M, Barritault D, van Neck JW. . Wound Repair and Regeneration. 2009, 17 (6): 840–52. PMID 19903305. S2CID 17262546. doi:10.1111/j.1524-475X.2009.00548.x.
- Tong M, Tuk B, Hekking IM, Pleumeekers MM, Boldewijn MB, Hovius SE, van Neck JW. . Wound Repair and Regeneration. 2011, 19 (4): 505–14. PMID 21649786. S2CID 7380997. doi:10.1111/j.1524-475X.2011.00704.x.
- Tong, Miao; Tuk, Bastiaan; Hekking, Ineke M.; Vermeij, Marcel; Barritault, Denis; van Neck, Johan W. . Wound Repair and Regeneration (Wiley). 2009, 17 (6): 840–852. ISSN 1067-1927. doi:10.1111/j.1524-475x.2009.00548.x.
- Laguri, Cédric; Sapay, Nicolas; Simorre, Jean-Pierre; Brutscher, Bernhard; Imberty, Anne; Gans, Pierre; Lortat-Jacob, Hugues. . Journal of the American Chemical Society (American Chemical Society (ACS)). 2011-06-08, 133 (25): 9642–9645. ISSN 0002-7863. doi:10.1021/ja201753e.