雷迪帕韋/索磷布韋
雷迪帕韋/索磷布韋(英語:),以商品名Harvoni(夏奉寧)等在市面銷售,是一種用於治療C型肝炎的藥物。[8]它是由兩種治療C型肝炎的藥物 - 雷迪帕韋和索磷布韋組合而成的複方藥物。[8]在C型肝炎病毒 (HCV) 基因型 1感染者的治癒率為94%至99%。[9]有些證據也支持罹患HCV基因型 3和 4的患者使用。[9]患者須每天口服給藥,療程持續8-24週。[8]
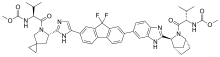 雷迪帕韋結構圖 | |
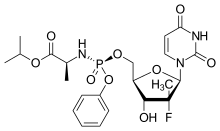 索非布韋結構圖 | |
| 臨床資料 | |
|---|---|
| 商品名 | Harvoni(夏奉寧)、Hepcinat-LP及其他 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a614051 |
| 核准狀況 | |
| 懷孕分級 | |
| 给药途径 | 口服給藥 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 识别 | |
| PubChem CID | |
| KEGG | |
| 化学 | |
| 化学式 | C71H83F3N11O15P |
| 摩尔质量 | 1,418.48 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
通常服藥者會有良好的耐受性。[10]常見的副作用有肌肉疼痛、頭痛、噁心、皮疹和咳嗽。[8]目前尚不清楚個體在懷孕期間使用對胎兒是否安全。[8]雷迪帕韋透過降低NS5A的活性來發揮作用,而索磷布韋透過降低NS5B的活性來發揮作用。[8]
雷迪派韋/索磷布韋於2014年在美國、歐盟和加拿大被批准用於醫療用途。[8][11][5][12][13]此藥物也被列入世界衛生組織基本藥物標準清單之中。[14]
醫療用途
基因 1型感染者的治癒率為94%至99%(基因 1型感染者佔HCV病例的46%)。[15]醫界還對其他C型肝炎基因型感染的治療進行評估,雖然它在基因型 3和4(分別佔HCV病例的30%和不到22%)方面的治療顯示出令人鼓舞的結果。[9][7][16][15]但尚未有最後結果出現。
NS5A突變
由於多種作用機制,需要多個HCV複製子突變才能對抗藥性產生顯著影響。[17]一般來說,HCV基因型 1a比基因型 1b更不容易產生具抗藥性的突變。[18]
對於基因型1b,複製子中的單一氨基酸(例如L31V)被取代對使用Harvoni(夏奉寧)的抗藥性增加不到100倍,而兩個氨基酸遭到取代則會讓抗藥性增加超過1,000倍。[18][19]具有基因型 1a的個體罹患C型肝炎後,隨著某些關鍵氨基酸發生額外改變,對治療的抗藥性往往會增加。這些關鍵氨基酸是K24、M28、Q30、L31和Y93,任何改變(例如轉換為 R、T/V、R/H/K/L、M或H/N)都可能導致病毒更難清除。[7]
NS5A的多態性也會影響病毒抗藥性,在快速病毒反應 (RVR) 患者中,最常見的抗藥性相關氨基酸取代位點出現在Q30R、Y93H或Y93N和L31M。[7]臨床試驗中觀察到的特定基線NS5A(在開始HCV治療之前,患者血液中HCV病毒基因組中NS5A蛋白的基因變異)抗藥性相關多態性包括基因型 1a中的M28T/V、Q30H、Q30R、L31M、H58P、Y93H和Y93N,以及基因型 1b中的L28M、A92T和Y93H。[7]具有多個基線NS5A多態性的患者在使用雷迪帕韋/索磷布韋時往往復發率稍高。[7]患者在基線NS5A多態性存在與否,於未有治療經驗組和有治療經驗組之間,在12週療程後復發率的差異為1%,在24週療程後的差異為0%。[18][7]
副作用
超過10%的患者在服用雷迪帕韋/索磷布韋後會出現頭痛或疲勞,服用者中有1%至10%會出現皮疹、噁心、腹瀉和失眠。[7][6]
更嚴重的反應與藥物過敏反應和心血管問題有關。使用Harvoni較使用舊的基於干擾素的治療相比,會有相對較輕的副作用。
雷迪帕韋/索磷布韋可能導致B型肝炎病毒和C型肝炎病毒合併感染者中B型肝炎重新活化。歐洲藥品管理局建議在開始使用雷迪帕韋/索磷布韋治療C型肝炎之前,對所有患者進行B型肝炎篩檢,以儘量降低B型肝炎再活化的風險。[22]
藥物交互作用
雷迪帕韋/索磷布韋是藥物運輸蛋白P-醣蛋白 (P-gp) 和乳腺癌耐藥蛋白 2 (BCRP) 的基質。[18]服用如利福平和貫葉連翹等誘導劑可能會降低腸道吸收這類藥物運輸蛋白基質的作用。[23]
也建議患者不可服用H2受體拮抗劑 (H2RA) 和氫離子幫浦阻斷劑 (PPI),因為它們會降低雷迪帕韋的濃度(其溶解度取決於pH值,在酸性條件下溶解度會較高)。或是在服用雷迪帕韋/索磷布韋後至少須過兩小時再服用PPI(每日劑量不超過20毫克),並建議每日服用H2RA的劑量不超過40毫克(分兩次服用)。[18][24]
服用胺碘酮或其他降低心率的藥物時,也應避免服用雷迪帕韋/索磷布韋,當此類藥物與雷迪帕韋/索磷布韋一起使用時,會有導致心跳過緩或是停止的重大風險。[7][6]
作用機轉
與服用雷迪帕韋/索磷布韋最常見的相關機制是C型肝炎病毒非結構蛋白 5A(NS5A) 的過度磷酸化,NS5A是一種病毒聚合酶,對於正確的病毒構成非常重要,且其會干擾正常的肝臟代謝。[25]雷迪帕韋/索磷布韋透過將NS5A的亞細胞重新定位,而可抑制正確的病毒構成。[18]
C型肝炎病毒非結構蛋白 5B(NS5B)是一種可啟動RNA從頭開始組裝的病毒聚合酶,也會被雷迪帕韋/索磷布韋異位調節作用所抑制。[26]
藥物代謝動力學
索磷布韋可在血漿中被快速吸收,給藥後0.8至1小時達到最大血藥濃度 (Cmax),並進行額外的肝代謝,其中61%至65%與人類血漿蛋白結合。[28][18]然後,它主要會轉化為無活性的無磷酸鹽循環代謝產物 - GS-331007(透過腎臟被動過濾而消除76%),其在攝入後3.5至4小時內達到中位血藥濃度。[7]空腹和進食狀態下服用索磷布韋似乎對其吸收不具影響。[29]
雷迪帕韋在攝取後4至4.5小時內在體內達到最大濃度,且不受常量營養素(即進食後,消化道中有碳水化合物、蛋白質、脂肪)的影響。[18][7]它會與超過98%的血漿蛋白結合,主要透過糞便排除,極少受到肝臟代謝。[7]
排除
90毫克[添加碳-14同位素]-雷迪帕韋/索磷布韋劑量的生物半衰期為47小時,對於400毫克 [添加碳-14]-索磷布韋的生物半衰期為0.5小時(藥物在身體組織中分佈之後)和27小時(藥物最終排出人體)。[7][30]
| 物質 | 奈克/毫升 |
|---|---|
| 雷迪帕韋 | 323 |
| 索磷布韋 | 618 |
| 循環代謝產物GS-331007 | 707 |
備註:健康個體的最大血藥濃度比感染C型肝炎病毒患者的高出32%[7]
| 物質 | 奈克*小時/毫升 |
|---|---|
| 雷迪帕韋 | 7,290 |
| 索磷布韋 | 1,320 |
| 循環代謝產物GS-331007 | 12,000 |
附註:健康個體的最大血藥濃度比感染C型肝炎病毒患者的高出24%[7]
社會與文化
美國大型生物製藥公司吉利德科學公司是此種藥物的生產者之一。[8]該公司於2015年1-9月在Harvoni的全球銷售金額估計為105億美金(美國市場銷售金額83.8億美金)。[32]而該公司在2022年與HCV有關藥物(包含Harvoni)的銷售金額為18億美金(美國市場銷售金額10億美金)。[33]
參見
- . Drugs.com. 2019-10-28 [2020-03-17]. (原始内容存档于2020-03-17).
- . Therapeutic Goods Administration (TGA). 2015-10-29 [2020-08-29]. (原始内容存档于2022-05-07).
- . Therapeutic Goods Administration (TGA). 2017-11-16 [2020-08-29]. (原始内容存档于2022-05-07).
- . Therapeutic Goods Administration (TGA). 2022-06-21 [2023-04-10]. (原始内容存档于2023-04-10).
- . European Medicines Agency (EMA). 2018-09-17 [2020-08-29]. (原始内容存档于2023-11-05).
- . UK Electronic Medicines Compendium. December 2016 [2017-02-04]. (原始内容存档于2016-10-27).
- . DailyMed. 2020-03-16 [2020-08-29]. (原始内容存档于2023-04-17).
- . The American Society of Health-System Pharmacists. [2016-12-08]. (原始内容存档于2016-12-25).
- Keating GM. . Drugs. April 2015, 75 (6): 675–685. PMID 25837989. S2CID 31943736. doi:10.1007/s40265-015-0381-2.
- World Health Organization. . Geneva: World Health Organization. 2015: 69–70. ISBN 9789241209946. ISSN 0512-3054. hdl:10665/189763
 . WHO technical report series;994.
. WHO technical report series;994. - . U.S. Food and Drug Administration (FDA). 2014-11-03 [2020-08-29]. (原始内容存档于2023-11-05).
(PDF) (Summary Review). Center for Drug Evaluation and Research. [2024-02-01]. (原始内容存档 (PDF)于2022-12-08). - . 2010-08-25 [2024-02-01]. (原始内容存档于2022-05-07).
- (新闻稿). Gilead Sciences, Inc. 2014-10-16 [2020-08-29]. (原始内容存档于2024-01-12) –Business Wire.
- World Health Organization. . Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO. - Messina JP, Humphreys I, Flaxman A, Brown A, Cooke GS, Pybus OG, Barnes E. . Hepatology. January 2015, 61 (1): 77–87. PMC 4303918
 . PMID 25069599. doi:10.1002/hep.27259.
. PMID 25069599. doi:10.1002/hep.27259. - . Rapid Response Service (Canadian Agency for Drugs and Technologies in Health). 2015-01-16. PMID 25674658. (原始内容存档于2017-11-05).
- Issur M, Götte M. . Viruses. November 2014, 6 (11): 4227–4241. PMC 4246218
 . PMID 25384189. doi:10.3390/v6114227
. PMID 25384189. doi:10.3390/v6114227  .
. - Gritsenko D, Hughes G. . P & T. April 2015, 40 (4): 256–276. PMC 4378517
 . PMID 25859119.
. PMID 25859119. - Gao M. . Current Opinion in Virology. October 2013, 3 (5): 514–520. PMID 23896281. doi:10.1016/j.coviro.2013.06.014.
- Vermehren J, Sarrazin C. . Best Practice & Research. Clinical Gastroenterology. August 2012, 26 (4): 487–503. PMID 23199507. doi:10.1016/j.bpg.2012.09.011.
- (PDF). Gilead Sciences. March 2020 [2018-02-21]. (原始内容存档 (PDF)于2018-02-22).
- . European Medicines Agency (EMA). 2018 -09-17 [2020-02-04]. (原始内容存档于2020-02-03).
- . www.natap.org. [2018-02-22]. (原始内容存档于2018-03-01).
- . www.natap.org. [2018-02-22]. (原始内容存档于2017-01-31).
- Gong G, Waris G, Tanveer R, Siddiqui A. . Proceedings of the National Academy of Sciences of the United States of America. August 2001, 98 (17): 9599–9604. Bibcode:2001PNAS...98.9599G. PMC 55498
 . PMID 11481452. doi:10.1073/pnas.171311298
. PMID 11481452. doi:10.1073/pnas.171311298  .
. - Lin MV, Chung R. . Clinical Liver Disease. March 2014, 3 (3): 65–68. PMC 6448702
 . PMID 30992888. doi:10.1002/cld.332.
. PMID 30992888. doi:10.1002/cld.332. - Pawlotsky JM. . Journal of Hepatology. August 2013, 59 (2): 375–382. PMID 23567084. doi:10.1016/j.jhep.2013.03.030
 .
. - . www.drugbank.ca. [2018-03-23]. (原始内容存档于2018-03-24).
- Cada DJ, Baker DE, Bindler RJ. . Hospital Pharmacy. March 2015, 50 (3): 224–234. PMC 4567193
 . PMID 26405313. doi:10.1310/hpj5003-224.
. PMID 26405313. doi:10.1310/hpj5003-224. - . www.kumc.edu. [2018-03-23]. (原始内容存档于2018-01-15).
- Elkady EF, Aboelwafa AA. . Journal of AOAC International. September 2016, 99 (5): 1252–1259. PMID 27480956. doi:10.5740/jaoacint.16-0021.
- . Gilead Sciences. 2015-10-27 [2024-01-12]. (原始内容存档于2023-09-26).
- . Gilead Sciences. 2023-02-02 [2024-01-12]. (原始内容存档于2024-01-21).