3-甲基戊烷
3-甲基戊烷,是五個一結構異構體的己烷,也是分子式為的支鏈烷烴,是在正戊烷的第三個碳原子上的氢被甲基取代,所形成的己烷的結構異構體。
| 3-甲基戊烷[1] | |||
|---|---|---|---|
| |||
| IUPAC名 3-Methylpentane | |||
| 识别 | |||
| CAS号 | 96-14-0 | ||
| PubChem | 7282 | ||
| ChemSpider | 7010 | ||
| SMILES |
| ||
| Beilstein | 1730734 | ||
| UN编号 | 1208 | ||
| EINECS | 202-481-4 | ||
| ChEBI | 88373 | ||
| RTECS | SA2995500 | ||
| MeSH | 3-methylpentane | ||
| 性质 | |||
| 化学式 | C6H14 | ||
| 摩尔质量 | 86.18 g·mol−1 | ||
| 外观 | 透明澄清液體 | ||
| 氣味 | 無臭 | ||
| 密度 | 664 mg mL−1 | ||
| 熔点 | -118 °C(155 K) | ||
| 沸点 | 63 °C(336 K) | ||
| 溶解性(水) | 不可溶 | ||
| log P | 3.608 | ||
| 蒸氣壓 | 18.0 kPa (at 17 °C) | ||
| kH | 8.8 mol Pa−1 kg−1 | ||
| 磁化率 | -75.52·10−6 cm3/mol | ||
| 折光度n D |
1.376 | ||
| 热力学 | |||
| ΔfHm⦵298K | −203.0–−201.0 kJ mol−1 | ||
| ΔcHm⦵ | −4.1608–−4.1590 MJ mol−1 | ||
| S⦵298K | 292.5 J K−1 mol−1 | ||
| 热容 | 191.16 J K−1 mol−1 | ||
| 危险性 | |||
GHS危险性符号    | |||
| GHS提示词 | DANGER | ||
| H-术语 | H225, H304, H315, H336, H411 | ||
| P-术语 | P210, P261, P273, P301+310, P331 | ||
| 爆炸極限 | 1.2–7.7% | ||
| PEL | none[2] | ||
| 相关物质 | |||
| 相关化合物 | |||
| 相关化学品 |
| ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
命名
由IUPAC命名法指定的“3-甲基戊烷”
“3-甲基”表示一顆碳原子與主幹第三個碳相接
“戊烷”表示主幹上有五個碳
安全性
3-甲基戊烷形成高度易燃的蒸汽 - 空氣混合物
該化合物的閃點低於-20℃
以上所述的爆炸範圍是1.2之間體積%(40克/米3)[5]比爆炸下限(LEL)和7.0%(體積)(250克/米3)作為爆炸上限(UEL)[6]
所述的點火溫度為300℃ 所述的織物因而落入內溫度類 T3。
特性
3-甲基戊烷是可燃的,易揮發的無色液體,苯酚氣味
在1大氣壓下,該化合物的沸點為63℃
該蒸氣壓力函數由下式給出log10(P) = A−(B/(T+C))( P是巴(bar),T是凱氏溫標(K) )
其中A = 3.97377 B = 1152.368和C = -46.021的溫度範圍內289K至337K [7]
最重要的熱力學性質列於下表:
| 屬性 | 單位 | 數值 |
|---|---|---|
| 標準焓 | ΔfH0gas | −171,6 kJ·mol−1[8] |
| 標準摩爾熵 | S0liquid
S0g |
292,5 J·mol−1·K−1[9] 液體
382,88 J·mol−1·K−1[9] 氣體 |
| 燃燒熱 | ΔcH0liquid | −4159,98 kJ·mol−1[9] |
| 熱容量 | cp | 191,16 J·mol−1·K−1 (25 °C)[10]液體 |
| 熔融焓 | ΔfH0 | 5,3032 kJ·mol−1[9]在熔點 |
| 融化 | ΔfS0 | 48,101 kJ·mol−1[9]在熔點 |
| 蒸發 | ΔVH0 | 28,08 kJ·mol−1[11]在常壓下的沸點
30,47 kJ·mol−1[12] 在25℃下 |
| 臨界溫度 | TC | 231 °C[13] |
| 臨界壓力 | PC | 31,1 bar[13] |
| 臨界體積 | VC | 0,368 l·mol−1[13] |
| 臨界密度 | ρC | 2,72 mol·l−1[13] |
蒸發焓的溫度依賴性可以根據等式
ΔVH0=A·exp(−β·Tr)(1−Tr)β (ΔVH0 的單位是kJ/mol,Tr =(T/Tc)降低溫度),在298K和353K之間的溫度範圍內, A = 45,24 kJ/mol, β = 0,2703 und Tc = 504,4 K[14]
物理性質和同分異構體
3-甲基戊烷是一種無色液體,具有微弱的特殊氣味(苯酚味)
C6H12顯示出了4個異構體:
- 己烷(正己烷):CH3(CH2)4CH3
- 2-甲基戊烷(異己烷):CH3CH2CH2CH(CH3)2
- 2,2-二甲基丁烷(新己烷):CH3CH2C(CH3)3
- 2,3-二甲基丁烷:(CH3)2 CHCH(CH3)2
| 結構式 | 名稱 | 分子量 | 沸點(°C, 1 atm) | 結構簡式 |
| 正己烷
己烷 |
86,18 | 69 | CH3(CH2)4CH3 | |
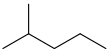 |
2-甲基戊烷
異己烷 |
58,12 | 60 | (CH3)2CH(CH2)2CH3 |
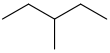 |
3-甲基戊烷 | 58,12 | 64 | CH3CH2CH(CH3)CH2CH3 |
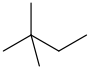 |
2,2-二甲基丁烷
新己烷 |
58,12 | 49,73 | CH3C(CH3)2CH2CH3 |
 |
2,3-二甲基丁烷 | 58,12 | 57,9 | CH3CH(CH3)CH(CH3)CH3 |
生產(製備)
透過合成反應製備:低級碳鏈的起始原料
因此,製備純3-甲基戊烷的最簡單的方法是:[16]
1.仲丁基鹵化物 與 乙基鋰 或 丁基鋰 與 乙基鹵化物 反應
或
2.武慈(Wurtz)反應可以得到該產品的混合物:[17]
還原鹵代化合物
或
或
或
2. 氫化鋁鋰(LiAlH4) 或 硼氫化鈉(NaBH4):[19]
或
或
或
或
或
或
4. 使用甲矽烷(SiH4)中還原烷基鹵化物,在三氟化硼的催化下製備丁烷:[21]
或
或
或
或
或
或
氫化不飽和烴
1. 3-甲基-1-戊烯:[25]
2. 3-甲基-2-戊烯:[25]
3. 2-乙基-1-丁烯:[25]
4. 3-甲基-1,2-戊二烯:[25]
5. 3-甲基-1,3-戊二烯:[25]
6. 3-甲基-1,4-戊二烯:[25]
7. 3-甲基戊烷-1:[26]
8. 3-甲基-1,2,4-戊二烯:[25]
化學性質
氧化
1.完全燃燒:就像所有的烷烴一樣,3-甲基戊烷與過量的氧氣燃燒,產生二氧化碳和水:[32]
2.水煤氣:
3.催化氧化的主要產物為3-甲基戊醇-3:
4.使用高錳酸鉀(KMnO4)氧化的產物為3-甲基戊醇-3:
鹵化[36]
- X的活性:氟(F2) >氯(Cl2) >溴(Br2) >碘(I2)。
- 其中0 <A,B,C,D <1,A + B + C + D = 0
- 氟(F2)和氯(Cl2)的活性高,選擇性低,丙基鹵化物的比例主要取決於置換氫原子比例,氯:
- 3-甲基戊基氯-1: 6x1 = 6
- 3-甲基戊基氯-2: 4x3.8 = 15.2
- 3-甲基戊基氯-3: 1x5 = 5
- 2-乙基丁基氯-1: 3x1 = 3
- 也就是說,所得混合物為:
- 20.5% 3-甲基戊基氯-1
- 52.1% 3-甲基戊基氯化物-2
- 17.1% 3-甲基戊基氯化物-3
- 10.3% 2-乙基丁基氯化物-1
- 溴(Br2)和碘(I2),較不活躍所以更具選擇性
- 3-甲基戊基溴-1: 6x1 = 6
- 3-甲基戊基溴-2: 4x82 = 328
- 3-甲基戊基溴-3: 1x1600 = 1600
- 2-乙基丁基溴-1: 3x1 = 3
- 也就是說,所得混合物為:
- 0.3% 3-甲基戊基溴-1
- 16.9% 3-甲基戊基溴-2
- 82.6% 3-甲基戊基溴-3
- 0.1% 2-乙基丁基溴化物-1
CH3CH2CH(CH3)CH2CH3的氯化分析:
- 然而,在製造單鹵化物時,實際上難以停止反應,如果使用等摩爾量的CH3CH2CH(CH3)CH2CH3和X2 則將產生CH3CH2CH(CH3)CH2CH3的全部鹵素衍生物的混合物
- 如果使用過量的CH3CH2CH(CH3)CH2CH3,則單一衍生物的產率,由於與自由基遇到和X的機率相關的CH2CH2CH(CH3)CH2CH3(CH3)2的統計機率的增加而大大增加
- 導致剩餘的X衍生物的生產
碳烯干擾
- 碳烯在六鍵 CH-1,5- 2 -h:6
- 碳烯在四鍵 2,4-CH-H:4
- 插鍵CH:1
- 三個插入物(3)鏈路CH-1' 2 -H):4。
- 因此,存在3-甲基己烷(〜43%),2,3-二甲基戊烷(〜29%),3,3-二甲基戊烷(〜7%)和乙基戊烷(-29%)的混合物
参考文獻
- . PubChem Compound. USA: National Center for Biotechnology Information. Identification and Related Records. 26 March 2005 [5 March 2012].
- NIOSH Pocket Guide to Chemical Hazards. . NIOSH.
- . [2017-08-24]. (原始内容存档于2020-02-22).
- Entry on Methylpentane. at: Römpp Online. Georg Thieme Verlag, retrieved 16. Juni 2014.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- C. B. Williamham, W. J. Taylor, J. M. Pignocco, F. D. Rossini: Vapor Pressures and Boiling Points of Some Paraffin, Alkylcyclopentane, Alkylcyclohexane, and Alkylbenzene Hydrocarbons, in: J. Res. Natl. Bur. Stand. (U.S.), 1945, 35, S. 219–244.
- E. J. Prosen, F. D. Rossini: Heats of combustion and formation of the paraffin hydrocarbons at 25 °C, in: J. Res. Natl. Bur. Stand. (U.S.), 1945, 35, S. 263–267.
- H. L. Finke, J. F. Messerly: 3-Methylpentane and 3-methylheptane: low-temperature thermodynamic properties, in: J. Chem. Thermodyn., 1973, 5, S. 247–257, doi:10.1016/S0021-9614(73)80085-0.
- K. Ohnishi, I. Fujihara, S. Murakami: Thermodynamic properties of decalins mixed with hexane isomers at 298.15K. 1. Excess enthalpies and excess isobaric heat capacities, in: Fluid Phase Equilib., 1989, 46, S. 59–72, doi:10.1016/0378-3812(89)80275-4.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- I. Wadso: A heat of vaporization calorimeter for work at 25 °C and for small amounts of substances, in: Acta Chem. Scand., 1966, 20, S. 536–543, doi:10.3891/acta.chem.scand.20-0536.
- T. E. Daubert: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes, in: J. Chem. Eng. Data, 1996, 41, S. 365–372, doi:10.1021/je9501548.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- A. A. O’Kelly, A. N. Sachanen: Alkylation of Paraffins in the Presence of Homogeneous Catalysts. synthesis of Neohexane and Triptane, in: Ind. Eng. Chem., 1946, 38, S. 462–467, doi:10.1021/ie50437a010.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2β, R = CH3CH2, R' = CH3CH2CH2CHCH3
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CΗCH2
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CΗCH2
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CΗCH2
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.5.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6α, R = CH3, R' = CH3CH2CH2CH(CH3)2
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = CH3CH(CH3)CH2CH2 ή CH3CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH3
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 6 και μετατροπή μονάδας ενέργειας σε kJ.
- ΔHC-C= +347 kJ/mol
- ΔHC-H = +415 kJ/mol
- ΔHO-O=+146 kJ/mol
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH2
- καθοριστικό ταχύτητας}
- 不因空間位置阻礙進行
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH2.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2, R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH2.
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 85, §6.3.
外部链接
- 有关于该烷烃材料安全性的资料(页面存档备份,存于)

