P4-t-Bu
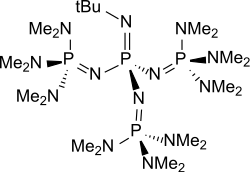
P4-t-Bu是一种中性、全烷基化的空間位阻的聚氨基磷腈,是極強的鹼,但親核性非常弱。 P4-t-Bu可以看成基本结构为(H2N)3P=NH的三氨基亚氨基正膦的四聚体。表示P1至P7聚氨基[1][2]的同系物的通式,倾向于选择甲基为R1,甲基或叔丁基為0和6之間的偶數x (P4-t-Bu: R1 = Me, R2 = t-Bu und x = 3 )[3]由 Reinhard Schwesinger 開發。因此,所得的磷腈鹼也稱為Schwesinger超鹼。[4][5]
| P4-t-Bu | |
|---|---|
 | |
| 识别 | |
| CAS号 | 111324-04-0 |
| PubChem | 4339838 |
| SMILES |
|
| 性质 | |
| 化学式 | C22H63N13P4 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
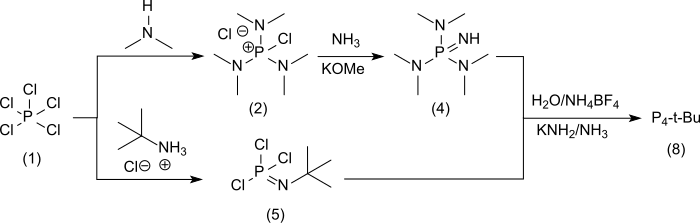
P4-t-Bu[6]的合成通过五氯化磷(1),並在 [A] 中通過非分離的氯 (二甲氨基) 氯化鏻(2)[2]經由 [(二甲氨基) 鏻四氟硼酸鹽 (3) 並進一步經由 [A2] 得到液態亞氨基三(二甲氨基)正膦[7] (4)
-
[]
[]
[]
并在支路 [ B ] 中與五氯化磷和叔丁基氯化銨合成叔丁基磷酰亞胺三氯化物 (5)[8]
-
[]
过量(4)与(5)反应[ C ]得到目标产物P4-t-Bu(6)的盐酸盐,收率93%
-
([])
它也可以转化为四氟硼酸盐 (7),可以用甲醇钾/氨基钠[2]或用氨基钾在液氨中几乎定量地从中获得游离碱 (8)。[9]将吸湿性和易溶于水的盐酸盐和液体游离碱转移到难溶于水的四氟硼酸盐中,极大地促进了物质的处理。
-
[]
特性
P4-t-Bu是最强的中性含氮碱的外推pKa值為42.1,與pKa值為24.3的強鹼DBU相比,碱性强18个数量级。[2]该化合物极易溶于非极性溶剂,如己烷、甲苯或四氢呋喃,通常以0.8至1摩爾的己烷溶液形式市售。[10]在弱酸性介质中质子化產生了極度離域和柔軟的P4-t-Bu-H陽離子,並且除了非常強的增溶作用之外,即使在低於-78°C也會導致加成反應的極端加速。
P4-t-Bu具有极高的碱度和低的亲核性,这归功于其非常高的空间位阻以及許多供體基團與質子化形成的陽離子的需要空間的結構共軛的參與。
P4-t-Bu是一种吸湿性极强的固体,热稳定性高达120 °C,对(干)氧和碱化学稳定。[9]溴乙烷可以消除痕量的水和质子杂质。该碱既非常亲水又非常亲油,并且可以通过形成微溶的四氟硼酸盐方便且几乎完全地从反应混合物中回收。
由于其极弱的路易斯碱度,P4-t-Bu的阳离子可抑制金属有机基团的典型副反应(如羟醛缩合),这可能由氨基锂如二异丙氨基锂(LDA)引起[11]
应用
如果中性超强碱P4-t-Bu对氧化或副反应(如酰化)敏感,则它们会导致溶解度问题或路易斯酸催化的副反应(如醛醇反应、环氧开环等)。
它可以与正烷基溴化物脱卤产生烯烃,例如 1-溴辛烷与P4-t-Bu的反应在温和条件下几乎定量 (96%)产生1-辛烯,叔丁醇钾/18-冠-6系统收率仅为75%。[12]
弱酸性亚甲基上的烷基化(例如在羧酸酯或腈的情况下)以高产率和选择性进行。例如,在P4-t-Bu存在下,通过8-苯基甲基苯基乙酸酯与碘乙烷的反应,可以以95%的产率获得Z构型的单乙基衍生物。[13]
丁二腈与碘乙烷在 P4-t-Bu存在下以 98% 的产率反应生成四乙基衍生物,而无需经历索普-齐格勒反应以形成环状α-酮腈。[9]
使用惰性氟仿(HFC-23)在 P4-t-Bu和三(三甲基甲硅烷基)胺存在下,酮(如二苯甲酮)的三氟甲基化也可以在室温下以高达84%的良好收率进行。[14]
在没有金属催化剂的温和条件下,在 P4-t-Bu 存在下,邻炔基苯基醚的分子内环化取代苯并呋喃。[15]
由于它的极端碱性,早期有人建议P4-t-Bu适合作为阴离子聚合的引发剂。使用乙酸乙酯/P4-t-Bu引发剂体系,可以在THF中获得多分散性窄、摩尔质量高达40,000 g·mol-1的聚甲基丙烯酸甲酯(PMMA)。[11]
环氧乙烷与引发剂体系正丁基锂/P4-t-Bu的阴离子聚合产生具有低多分散性的明确定义的聚环氧乙烷。[16]
环状硅氧烷(如六甲基環三矽氧烷或十甲基環五矽氧烷)也可以在良好的分子量控制下,以催化量的P4-t-Bu和水或矽烷醇作為引髮劑,聚合成分解溫度>450 °C的熱非常穩定的聚矽氧烷。[3][17]由于P4-t-Bu具有極高的鹼性,它會急切地吸收水和二氧化碳,這兩者都會抑制陰離子聚合。加熱到溫度 >100 °C時去除 CO2和水並恢復陰離子聚合。磷腈鹼P4-t-Bu作為一種物質和在溶液中的極端吸湿性要求在儲存和處理方面付出巨大努力,並阻礙其更廣泛的使用。
参考
- R. Schwesinger; et al, , Angew. Chem., 1993, 105 (9): 1420–1422, doi:10.1002/ange.19931050940 (德语)
- R. Schwesinger; et al, , Liebigs Ann. Chem., 1996, 7: 1055–10081, doi:10.1002/jlac.199619960705
- 6353075
- J. Saame; et al, , J. Org. Chem., 2016, 81 (17): 7349–7361, doi:10.1021/acs.joc.6b00872
- E.D. Nacsa; T.H. Lambert, , J. Am. Chem. Soc., 2015, 137 (32): 10246–10253, PMC 4617652
 , PMID 26131761, doi:10.1021/jacs.5b05033
, PMID 26131761, doi:10.1021/jacs.5b05033 - V. Gupta, , Ames, Iowa: Iowa State University, 2010
- 0921128
- R. Schwesinger; J. Willaredt; H. Schlemper; M. Keller; D. Schmitt; H. Fritz, , Chem. Ber., 1994, 127 (12): 2435–2454, doi:10.1002/cber.19941271215
- R. Schwesinger; Y. Kondo, , e-EROS Encyclopedia of Reagents for Organic Synthesis, 2010, doi:10.1002/047084289X.rp150.pub2
- . Sigma-Aldrich. [2016-12-20]. (原始内容 (PDF; 1,2 MB)存档于2017-06-21).
- T. Pietzonka, D. Seebach, , Angew. Chem., 1993, 105 (5): 741–742, doi:10.1002/ange.19931050514 (德语)
- R. Schwesinger; H. Schlemper, , Angew. Chem., 1987, 99 (11): 1212–1214, doi:10.1002/ange.19870991134 (德语)
- A. Solladié-Cavallo; A.G. Csaky; I. Gantz; J. Suffert, , J. Org. Chem., 1994, 59 (18): 5343–5346, doi:10.1021/jo00097a041
- S. Okusu; K. Hirano; E. Tokunaga; N. Shibata, , ChemistryOpen, 2015, 4: 581–585, PMC 4608523
 , PMID 26491635, doi:10.1002/open.201500160
, PMID 26491635, doi:10.1002/open.201500160 - C. Kanazawa; K. Goto; M. Terada, , Chem. Commun., 2009, (35): 5248–5250, doi:10.1039/B913588J
- B. Eßwein; M. Möller, , Angew. Chem., 1996, 108 (6): 703–705, doi:10.1002/ange.19961080620 (德语)
- P.C. Hupfield; R.G. Taylor, , J. Inorg. Organomet. Polym. Mater., 1999, 9 (1): 17–34, doi:10.1023/A:1021429320083