氟
在所有元素中,氟在宇宙中的丰度排名为24,在地壳中丰度排名13。萤石是氟的主要矿物来源,1529年该矿物的性质首次被描述。由于在冶炼中将萤石加入金属矿石可以降低矿石的熔点,萤石和氟包含有拉丁语中表示流动的词根fluo。尽管在1810年就已经认为存在氟这种元素,由于氟非常难以从其化合物中分离出来,并且分离过程也非常危险,直到1886年,法国化学家亨利·莫瓦桑才采用低温电解的方法分离出氟单质。许多早期实验者都因为尝试分离氟单质而受伤甚至去世。莫瓦桑的分离方法在现代生产中仍在使用。自第二次世界大战的曼哈顿工程以来,单质氟的最大应用就是合成铀浓缩所需的六氟化铀。
由于提纯氟单质的费用甚高,大多数的氟的商业应用都是使用其化合物,开采出的萤石中几乎一半都用于炼钢。其余的萤石转化为具有腐蚀性的氟化氢并用于合成有机氟化物,或者转化为在铝冶炼中起到关键作用的冰晶石。有机氟化物具有很高的化学稳定性,其主要用途是制冷剂、绝缘材料以及厨具(特氟龙)。诸如阿托伐他汀和氟西汀等药物也含有氟。由于氟离子能够抑制龋齿,氟化水和牙膏中也含有氟。全球与氟相关的化工业年销售额超过150亿美元。
碳氟化合物气体是温室气体,其温室效应是二氧化碳的100到20000倍。由于碳氟键强度极高,有机氟化合物在环境中难以降解,能够长期存在。在哺乳动物中,氟没有已知的代谢作用,而一些植物和海绵能够合成能够阻止食草动物的有机氟毒素,通常为氟乙酸盐。[13]
性质
电子排布
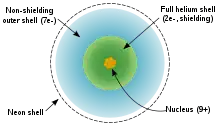
氟原子有9个电子,比氖原子少一个。其电子排布为1s22s22p5:内层填满了两个电子,外层离满壳层仅差一个电子。氟原子中外层电子不产生屏蔽效应,并且受到很高有效核电荷(9-2=7)的作用。这影响了氟原子的物理性质[2]。
氟拥有所有元素中第三高的第一电离能,仅次于氦和氖[14] ,这使得将电子从氟原子中剥离非常困难。氟的电子亲和能很高,仅次于氯[15],具有捕捉一个电子以变成稀有气体氖的等电子体的趋势[2]。氟的电负性是所有元素中最高的[16]。氟原子的共价半径也比较小,大约60 pm,与其在第二周期中相邻的元素氧和氖相似[17][18][note 1]。
反应
氟是自然界电负性最强的元素(3.98鲍林标度),也是氧化性最强的非金属单质。在常温下,氟能同绝大多数元素单质发生化合反应,并剧烈放热。和氢气即使在-250摄氏度的黑暗中混合也能发生爆炸,故液氟和液氢理论上适合用作高能液体火箭推进剂。氟分子中氟-氟键的键能和过氧化物中非常容易切断的过氧键类似,比与都低得多。这一性质和氟原子的高电负性使得氟容易分解、高度活跃,与其它非氟原子形成的化学键非常强[19][20]。诸如粉末钢、玻璃碎片、石棉纤维等不活跃物质都可以与氟气在低温下快速反应,木头和水在氟射流中可以自燃[3][21]。
| 外部 | |
|---|---|
氟和不同的金属的反应所需要条件不同。常温下,碱金属可以直接与氟反应并引起爆炸,碱土金属也可以直接与氟发生剧烈的反应。但是铝、铁这样的金属在常温下与氟作用,金属表面会形成一层氟化物而阻止反应进一步发生。换言之,它们会被氟钝化。如果要用这些金属和氟直接反应制备氟化物,需要将它们磨成粉末。[19]贵金属需要在300–450 °C 的温度下才能与纯氟发生反应[22]。
一些固体非金属元素如硫、磷等可以与液化氟在低温下反应[23]。硫化氢[23]与二氧化硫[24]容易与氟发生反应,后者有时甚至会发生爆炸。硫酸的活性较低,需要在较高的温度下才能与氟反应[25]。氢和一些碱金属类似,可以与氟发生爆炸性的反应[26]。碳以炭黑的形式可以在室温下与氟反应,生成四氟化碳。石墨与氟在高于400 °C发生反应产生非整比化合物氟化石墨,温度更高时产生气体的四氟化碳,有时还会发生爆炸[27]。二氧化碳和一氧化碳可以在室温或者略高于室温的条件下反应[28]。有机化合物,如甲烷、石蜡,会与氟剧烈反应[29],即使通常不可燃的有机物,如四氯化碳等完全取代的卤代烷也可能发生爆炸。尽管三氟化氮非常稳定,由于氮分子的三键键能较高,氮气需要在较高温度下才能与氟反应[31]。氨与氟能够发生爆炸性的反应[32][33]。氧与氟在常温常压下不发生反应,但是在低温和低压时通过放电可以使氟和氧化合,产物在加热时又会分解为其构成元素[34][35][36]。较重的卤素和稀有气体氡容易与氟发生反应,其它稀有气体中只有氙和氪在特殊条件下才能与氟发生反应。[37]
相态
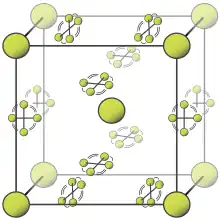
2分子,其它分子被限制在平面中。
在室温下,氟是一种由双原子分子构成的气体[3]。纯氟呈浅黄色,有时也被描述为黄绿色[38]。氟有一种特殊的刺激性气味,浓度在20ppb即可闻到[39]。在−188°C时,氟可以凝结为亮黄色液体,其沸点与氧气和氮气类似[40]。
氟有两种晶相,分别为α相和β相。β相在−220°C结晶,是一种软且透明的晶体,晶体结构不是其它卤素所形成的正交晶系结构[41][42],而是与刚结晶的固体氧相同的失序立方晶系结构[40][note 2]。进一步冷却至−228°C将使处于β相的氟转化为坚硬不透明的α相氟。α相氟属于单斜晶系,具有密集的成角度的分子层。β相氟转化为α相氟要比氟的凝固过程放出更多热量,相变过程比较剧烈。[41][42][note 3]。
同位素
氟只有一种稳定的天然同位素,即包含有10个中子的19
F[46]。该原子具有较高的磁旋比[note 4],原子核能级受磁场的影响比较明显。又由于氟仅有一种稳定同位素,它经常用于核磁共振。[48]目前一共合成了质量数从13到31的18种氟的放射性同位素,其中半衰期为109.77分钟的18
F最为稳定。其它同位素的半衰期都小于70秒,大多数都小于半秒钟。[46]同位素17
F与18
F的衰变方式为正电子发射和电子俘获,更轻的同位素的衰变方式为质子发射,而更重的同位素的衰变方式为β衰变(最重的同位素还会在β衰变之后发射中子)。[46]目前已知氟有两种核同质异能素,分别是半衰期为162纳秒的18m
F和半衰期为2.2毫秒的26m
F。[46]
存量
宇宙存量
| 原子序数 | 元素名 | 相对数量 |
|---|---|---|
| 6 | 碳 | 4,800 |
| 7 | 氮 | 1,500 |
| 8 | 氧 | 8,800 |
| 9 | 氟 | 1 |
| 10 | 氖 | 1,400 |
| 11 | 钠 | 24 |
| 12 | 镁 | 430 |
作为较轻的元素,氟在宇宙中的丰度相当低,约为400ppb,在各种元素中排名第24。其它的从碳至镁的轻元素丰度是氟的20倍甚至更多[50]。这是由于恒星核合成的反应过程跳过了氟,而其它反应中生成的氟原子具有较高的核截面,使得氟原子可以与氢原子或氦原子聚变生成氧原子或者氖原子[50][51]。
基於氟只能短暫存在,對氟的留存提出了三種解釋[50][52]:
- II型超新星的爆炸,產生的微中子轟擊氖原子核,使氖嬗變成氟。
- 沃夫–瑞葉星恆星風的吹拂,可以讓氟從與氫或氦原子分離,不致作用蛻變成氖。
- 在漸近巨星分支的恆星,其核融合產生的對流會孕育氟。
地球存量
氟是地壳中丰度排名第13的元素,其质量丰度为600-700ppm[53]。在地球大气层中,氟单质可以轻易的和大气中的水蒸气发生反应,因此无法在大气中自然出现[54][55]。氟仅以矿物质的形式出现,工业上主要的含氟矿物质为萤石、氟磷灰石以及冰晶石[53][56]。萤石的化学式为(),有各种颜色,在世界各地都大量分布。它是氟的主要来源,中国和墨西哥是萤石的主要生产国。20世纪早期,美国的萤石开采量在世界领先,但是1995年停止开采[56][57][58][59][60]。尽管氟磷灰石()含有的世界上最多的氟,其中氟的质量分数仅为3.5%,这意味它的大部分都是磷灰石。在美国,少量的氟化合物是通过氟硅酸得到的,这是一种磷酸盐工业的副产品[56]。曾经直接用于生产铝的冰晶石()是三种氟矿石中最稀少的也是氟含量最高的一种。格陵兰岛西海岸的商业冰晶石矿于1987年关闭,目前大多数的冰晶石都是人工合成的[56]。
| 主要的含氟矿石 | ||
 |
 |
 |
| 萤石 | 氟磷灰石 | 冰晶石 |
诸如黄玉等其它的矿物质也含有氟。氟化物与其它卤化物不同,不溶于水且不能以具有商业利益的浓度出现在盐水中[56]。曾经在火山喷发和地热喷泉中检测到了来源不明的痕量氟化物。[61]粉碎的呕吐石所发出的气味表明气体氟可能存在于晶体中[62][63] 。一项2012年的研究报告了呕吐石中含有质量分数约0.04%的,而这些氟可能来自于矿物质中存在的微量的铀[63]。
历史
早期发现

1529年,格奥尔格·阿格里科拉将萤石描述为在冶炼中用于降低金属熔点的添加剂[64][65][note 5]。他用拉丁词fluorés来表示萤石。该名字后来演化为fluorspar,直至fluorite[57][69][70]。萤石的成分后来被确定为氟化钙[71]。
早在1720年人们就已经开始使用萤石蚀刻玻璃[note 6]。马格拉夫于1764年从萤石和硫酸的混合物中分离出了一种新物质氢氟酸,他发现该物质腐蚀了玻璃容器[73][74]。瑞典化学家卡尔·威廉·舍勒于1771年重复了该实验,并将得到的酸性产物命名为fluss-spats-syran(萤石酸)[74][75]。1810年,法国物理学家安德烈-马里·安培提出氢和一种与氯类似的元素构成了氢氟酸[76]。汉弗里·戴维将这种当时未知的元素命名为氟fluorine,这一名字来自氟酸与其它卤素的后缀-ine。这个词经过变形在大多数欧洲语言中使用。希腊语、俄语、以及其他一些语言使用来自希腊语φθόριος 的ftor或其衍生词[77][78]。氟的元素符号来自于其拉丁文名称fluorum,在早期论文中也使用Fl作为其符号[79][note 7]。
日文音譯德文Fluor的第一個發音而稱之為「弗素」。19世紀70年代化學家徐壽將、、、、譯為輕氣、養氣、淡氣、弗氣、綠氣,直至1933年,化學家鄭貞文在其主持編寫出版的《化學命名原則》一書中改成氫、氧、氮、氟、氯,一直沿用至今。[80]
分离
对氟的研究最初相当危险,有数名19世纪的实验人员在不幸地接触到氢氟酸以后失去了生命,他们被称为氟烈士[note 8]。由于氟和氢氟酸具有极大的腐蚀性,并且当时缺少简单适用的电解质,分离氟单质的工作被严重阻碍了[71][81]。埃德蒙·弗雷米假定可以通过电解纯的氢氟酸来产生氟单质,并且设计了一种方法来通过酸化氟化氢钾来生产无水样本。然而他发现得到(干燥)的氟化氢无法导电[71][81][82]。弗雷米以前的学生亨利·莫瓦桑坚持研究,在经过多次的试错过程后发现氟化氢钾与无水氟化氢的混合物是一种导体,这样就可以应用电解法了。为了防止他的电化电池中的铂被快速腐蚀,莫瓦桑通过特殊的方式将其实验设备冷却至极低的温度,采用更耐腐蚀的铂铱合金作为电极,并且使用了萤石瓶塞[81][83]。1876年,在经过了74年和多位化学家的努力后,莫瓦桑终于制备出了氟单质[82][84]。
1906年,莫瓦桑在他去世的两个月前获得了诺贝尔化学奖[85],评奖委员会对其评价如下:[81]
表彰他对氟元素的研究和分离工作……全世界对您所研究的用于驯服最凶猛的元素的伟大实验技术表示尊敬。[note 9]
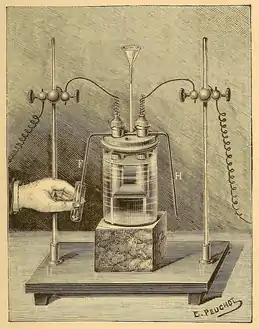 莫瓦桑的设备画像(1887)
莫瓦桑的设备画像(1887) 莫瓦桑的诺贝尔奖照片
莫瓦桑的诺贝尔奖照片
用途

通用汽车公司的北极品牌(Frigidaire)部门在20世纪20年代末期实验采用氯氟烃作为制冷剂。1930年,通用汽车与杜邦公司联合成立了动力化学公司以将氟利昂-12 (CCl
2F
2)推向市场。氟利昂取代了更早的毒性更强的制冷剂,增加了厨房电冰箱的需求,从而变得有经济利益。到1949年,杜邦公司已经买下了动力化学公司并销售了若干种其它氟利昂化合物[74][86][87][88]。1938年,在动力化学公司工作的罗伊·J·宾吉在研究制冷剂的事后偶然发现了聚四氟乙烯(特氟龙),该物质高超的化学稳定性与热稳定性使其快速商业化,在1941年开始了大规模生产[74][86][87]。
氟元素的大规模人工制备开始于二战期间。德国使用高温电解的方法生产了成吨的三氟化氯,计划用于燃烧弹[89];而曼哈顿工程使用大量氟生产六氟化铀以进行铀浓缩。由于UF
6一样具有腐蚀性,气体扩散工厂使用特殊的材料:薄膜以镍制造,密封件使用氟聚合物制造,并且使用碳氟化合物作为制冷剂与润滑剂。新兴的核工业驱动了战后氟化工的发展[90]。
化合物
氟可以产生丰富的无机和有机化学反应。它可以与金属、非金属以及类金属发生反应,甚至大多数稀有气体也都能和氟发生化学反应[91]。通常情况下氟的氧化数为-1[note 10]。氟的高电子亲和力导致其容易产生离子键;即使产生共价键,也容易产生极性,并且几乎总是单键[94][95][note 11]。
金属
碱金属离子可以与氟结合,形成易溶的单氟化物,这些化合物具有和氯化物类似的立方体结构[96][97]。除了二氟化铍碱土金属与氟形成的二氟化物也有很强的离子键,但是难溶[79]。二氟化铍表现出一些共价键的特征,并且具有类似石英的结构[98]。稀土元素以及许多其它的金属多与氟反应生成三氟化物[99][100][101]。
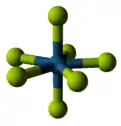
与氟形成的四氟化物开始表现出显著的共价键特征[102][103]。诸如锆、铪等以及若干锕系元素[104]与氟反应得到的产物为离子晶体,熔点较高[105][note 12],而钛[108]、钒[109]以及铌与氟得到的产物为聚合体[110],不超过350 °C就会熔解或者分解[111]。五氟化物以及它们的线性聚合物和低聚体复合物继续保持了这个趋势[112][113][114]。目前已知有13种金属六氟化物[note 13] ,都具有八面体结构,除了液体的MoF
6和ReF
6与气体的WF
6以外多为易挥发的固体[115][116][117]。七氟化铼是唯一的金属七氟化物,它使一种低熔点分子固体,具有双五角锥形分子构型[118]。有很多氟原子的金属氟化物特别活泼[119]。
| 金属氟化物结构演化 | ||
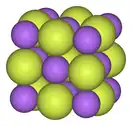 |
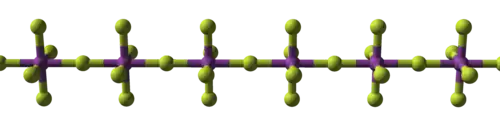 |
 |
| 氟化钠,离子晶体 | 五氟化铋,聚合物 | 七氟化铼, 分子晶体 |
氢
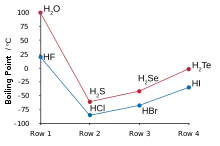
氢与氟相结合生成氟化氢,其中离散的分子通过氢键聚成团,从而与氯化氢相比,氟化氢的性质更接近水[120][121][122]。氟化氢的沸点比其它卤化氢高得多,而且可以与水以任意比例互溶,这一点也和其它卤化氢不同[123]。氟化氢接触水以后可以与水结合,生成水合氟化氢,亦称氢氟酸。与其它为强酸的氢卤酸不同,氢氟酸在低浓度时为弱酸[124][note 14]。然而,氢氟酸可以腐蚀玻璃,这一点其它氢卤酸无法做到[126]。
其它活泼的非金属元素
类金属与非金属的二氟化物通常是共价化合物,易挥发,具有不同的活泼程度。第三周期以及更重的非金属可以与氟形成高价氟化物[128]。
三氟化硼具有平面结构,为缺电子分子。作为一种路易斯酸,它可以与诸如氨等路易斯碱反应形成加合物[129]。四氟化碳为四面体结构,具有惰性[note 15],其它碳族元素与之类似,四氟化硅与四氟化锗都是四面体结构[130],但是表现为路易斯酸[131][132]。氮族元素与氟反应生成三氟化物,活跃度和碱性都随着分子量增加而增加,除了三氟化氮无法水解,不表现出碱性[133]。磷,砷和锑的五氟化物比其三氟化物更加活泼,五氟化锑是已知最强的中性路易斯酸[112][134][135]。
氧族元素具有不同的氟化物:有报告称氧、硫和硒可以和氟生成不稳定的二氟化物(二氟化氧是已知的氧具有正氧化数+的罕见化合物之一);硫、硒和碲可以与氟生成四氟化物与六氟化物。氟原子越多、中心原子越轻,氟化物就越稳定,因此六氟化硫相当稳定[136][137]。氯、溴和碘可以和氟反应生成一氟化物、三氟化物以及五氟化物,但是仅有碘可以和氟反应生成七氟化碘[138]。这些氟化物中许多种都可作为强氟原子源,并且三氟化氯在工业应用中需要与和使用氟一样小心谨慎。[139][140]
稀有气体
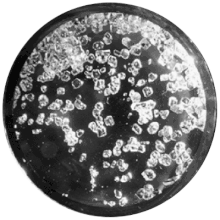
稀有气体具有满电子壳层,在1962年化学家尼尔·巴特利特报告了六氟合铂酸氙的合成以前,人们认为它们不与其他元素反应[142] 。从那以后,二氟化氙、四氟化氙、六氟化氙以及多种氧氟化物陆续被合成出来[143]。在其它稀有气体中,氪可以与氟形成二氟化氪[144],而氡可以与氟形成一种固体,据推测为二氟化氡[145][146]。氟与更轻的稀有气体形成的二元氟化物极不稳定。在极端条件下,氩可以与氟化氢结合产生氟氩化氢,氦与氖则无法形成稳定的氟化物[147],并且从未观察到氟化氖的存在[148]。高压低温下,曾经检测到寿命为若干毫秒的氟化氦[147]。
有机化合物

碳氟键是有机化学中最强的化学键[150],这是有机氟化物较为稳定的原因[151][note 16]。自然界中几乎不存在碳氟键,但是该化学键在人工化合物得到了应用。该领域的研究通常都具有商业目的[152],涉及到的化合物多种多样,这也反映出了有机化学的复杂性。
离散分子
将烷烃中的氢原子逐渐由更多的氟原子取代将会逐渐产生如下的性质的改变:熔点和沸点降低、密度增加、在烃中的溶解度下降,而整体的稳定性上升。全氟化碳中所有的氢原子都被氟取代了,它在大多数有机溶剂中都无法溶解,通常的条件下只能在液氨中与钠发生反应[153]。
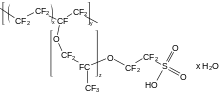
全氟化合物指的是除了官能团以外所有的氢原子都被氟原子取代的有机化合物[154][note 17],通常是羧酸。这些化合物与全氟化碳有许多共同的特征,例如稳定性、疏水性等等[156],而官能团则增加了他们的活跃度,使得他们可以附着于表面或者作为表面活性剂[157]。特别的,氟表面活性剂可以降低水的表面张力,效果比烃基活性剂更好。氟调聚物的官能团附近有一些未氟化的碳原子,它们也常被认为是全氟化物[156]。
聚合物
由于氟取代了单体中的氢原子,对应的聚合物的稳定性也相应的增加了,通常情况下其熔点也会增加[158]。聚四氟乙烯是最简单的氟聚合物,它是与聚乙烯对应的全氟化合物,结构单元为–CF
2–。该物质具有所预期的因氟取代氢所造成的变化,但是其非常高的熔点使得它难以造型。只有氟单质、三氟化氯、五氟化氯和熔融碱金属可以在高温下腐蚀聚四氟乙烯。氟化乙丙烯以三氟甲基取代了一些氟原子,全氟烷氧基烷烃以三氟甲氧基官能团取代一些氟原子[159],而全氟磺酸则包含有含有磺酸官能团的全氟醚侧链[160][161]。其它氟聚合物保留了一些氢原子,聚偏氟乙烯中一半的氢原子为氟原子所取代,聚氟乙烯则有四分之一的氢原子被取代,而二者具有和聚四氟乙烯相似的性质[162]。
生产
工业生产

莫瓦桑所提出的通过电解氟化氢与氟化钾混合物制备氟的方法可以用于工业生产,其中的氢离子在钢制成的阴极容器中还原生成氢气,而氟离子在碳制阳极被氧化生成氟气。阴极阳极之间的电压大约为8-12伏[58][163]。电解的温度有所提高,KF·2HF 在70 °C(158 °F)熔化,而电解温度为70—130 °C(158—266 °F)。氟可以使用具有钝化内层的钢罐在200 °C(392 °F)以下储存,否则将使用镍[74][164]。调节阀与管道使用镍制造,而管道也可以使用蒙乃尔铜镍合金制造[165]。使用氟必须对设备经常钝化,并且严格禁止接触水和油脂。在实验室中,在低温和无水的条件下可以使用玻璃器皿装氟气[165],某些文献推荐使用镍-蒙乃尔-聚四氟乙烯系统[166]。
工业应用
萤石矿的开采是全球氟的最大来源,1989年达到了560万吨的矿石开采量顶点。限制使用氯氟烃导致萤石产量下降,1994年下降到了360万吨。随后产量开始上升,2003达到了产量450万吨、产值55亿美元的规模。后续报告估计2011年全球氟化工的销售额达到了150亿美元,并且预测2016年将开采350万至590万吨矿石,产值将至少200亿美元[74][170][171][172][173]。泡沫浮选将开采出的萤石以相同比例分为两个主要的冶金等级:纯度为60-85%的冶金级萤石和纯度超过97%的酸级萤石。冶金萤石几乎全部用于钢铁冶炼,而酸级萤石主要被转化为关键的工业中间体氟化氢[58][74][174]。
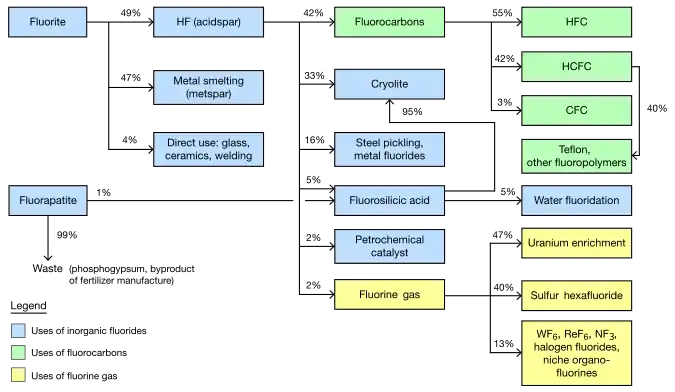

6变压器
每年全世界至少生产17000吨氟。氟的成本与六氟化铀或六氟化硫类似,每千克大约5-8美元,但是处理它的难度使其价格翻倍,而且大多数使用六氟化铀或者六氟化硫的工艺在垂直整合下都采用原地生产的方式[175]。
全世界对氟的最大的应用是在核燃料循环中生产,每年消耗近7000吨氟。首先二氧化铀与氢氟酸反应生成四氟化铀,然后四氟化铀被氟气氟化生成[175]。由于氟只有一种稳定的同位素,六氟化铀分子的任何质量区别都是由或者造成的。这使得可以通过气体扩散法或者气体离心法对铀进行浓缩[3][58]。每年大约有6000吨氟用于生产惰性电介质六氟化硫,该物质可以用于高压变压器与断路器,这样就不必在充油设备中使用危险的多氯联苯了[176]。电子产品中会使用一些氟化合物:在化学气相沉积中会使用六氟化钨或者六氟化铼,在等离子蚀刻中会使用聚四氟乙烯[177][178][179]和三氟化氮[58]。氟也被用于有机氟化物合成,但是由于其特别活泼,通常有必要先将其转化为更温和的、或以进行更精确的氟化。含氟医药通常使用四氟化硫代替氟[58]。
无机氟

每炼一吨钢或其它铁合金大约需要3.5千克冶金级萤石,氟离子降低了钢铁的熔点与粘性[58][180]。除了用于作为搪瓷和焊条涂层的添加剂以外,大多数酸级萤石与硫酸反应生成氢氟酸,而氢氟酸将会用于酸洗、玻璃蚀刻以及烷烃裂化[58]。氢氟酸产量的三分之一都用于合成冰晶石与三氟化铝,这是提炼铝的霍尔-埃鲁法中的重要助熔剂。由于它们偶尔会与熔炼设备发生反应,需要及时补充它们。每生产一吨铝大约需要23千克助熔剂[58][181]。氟硅酸盐消耗了第二多的氟。氟硅酸钠用于氟化饮用水和洗衣废水处理,并且是合成冰晶石与四氟化硅的过程中的中间体[182]。其它重要的无机氟化物包括氟化钴、氟化镍以及氟化铵[58][97][183]。
有机氟
有机氟消耗了萤石开采量的20%以及氢氟酸产量的40%,其中气体制冷剂占主要部分,而氟聚合物的市场份额在不断增长[58][184]。表面活性剂的应用较少,但是年产值超过10亿美元[185]。由于直接让烃与氟在高于−150 °C的条件下反应相当危险,工业上的氟碳化合物都是间接生产的,多通过卤素交换反应来完成,例如史瓦茨氟化反应在催化剂的作用下使氯烃与氟化氢反应,将氯原子替换为氟原子。电化学氟化将烃在氟化氢中电解,而福勒工艺使用诸如三氟化钴等的固体氟化物处理烃类[86][186]。
气体制冷剂
卤化制冷剂在非正式语境中常被称为氟利昂,由R-数标示,该数字标示了氟、氯、碳、氢的数量[58][187]。R-11、R-12、R-114等氟氯烃曾经占据了有机氟产量的主要部分,在20世纪80年代产量达到了顶峰。这些氟化物用于空调系统、推进剂或者用作溶剂。在国际上禁止使用以后,21世纪开始的产量已经下降至了峰值的十分之一[58]。为了取代氟利昂而设计出的氢氯氟烃(HCFC)和氢氟烃(HFC)的合成消耗了有机行业中超过90%的氟。重要的氢氯氟烃包括R22与R-141b。主要的氢氟碳化合物包括R-134a[58],而HFO-1234yf渐渐成为主流,这主要是因为HFO-1234yf的全球暖化潜势仅为R-134a的1%[188]。
氟聚合物

2006年与2007年大约生产了18万吨氟聚合物,产值达到每年35亿美元[189]。预计全球市场在2011年略少于60亿美元,到2016年将以每年6.5%的速度增长[190]。氟聚合物仅能通过自由基聚合形成[158]。
聚四氟乙烯(PTFE)通常被称作特氟龙,这是杜邦公司给它起的名字[191]。它占据了全世界氟聚合物产量的60-80%[189]。由于聚四氟乙烯是优秀的电介质,其最大应用就是电气绝缘。它在化学工业中也用于管道、油管以及垫片的涂料以防止腐蚀。聚四氟乙烯的另一重要应用是用于体育馆房顶的玻纤布涂层。聚四氟乙烯的主要消费应用是不粘厨具[191]。膨体聚四氟乙烯(ePTFE)是一种有细孔的薄膜,有时也被称为戈尔特斯(为其商标名),它常被用于制造雨衣、防护服以及过滤器。膨体聚四氟乙烯纤维可以制成机械密封装置和灰尘过滤器[191]。其它氟聚合物,包括氟化乙烯丙烯与聚四氟乙烯的性质类似,并且可以作为其替代品。这些氟聚合物更加容易成型,但是成本更高,热稳定性更低。两种氟聚合物制成的薄膜可以取代太阳能电池中的玻璃[191][192]。
成本较高但耐化学腐蚀的氟化离子交联聚合物可以用作电化学电池中的薄膜,其中最早也是最重要的物质为全氟磺酸。全氟磺酸是在20世纪60年代发展出来的,首先用于宇宙飞船的燃料电池材料,随后取代了汞基氯碱工艺电池。进来,燃料电池的应用随着将质子交换薄膜燃料电池安装在汽车上的努力重新获得了重视[193][194][195]。氟橡胶为交联的氟聚合物的混合物,主要用于O形环[191]。全氟丁烷 C
4F
10被用作灭火剂[196]。
表面活性剂
含氟表面活性剂为小分子含氟有机物,用于防水和防锈。尽管其价格昂贵,其年产值在2006年已达10亿美元;思高洁在2000年就已达到3亿美元的销售额[185][197][198]。含氟表面活性剂在整个表面活性剂市场中占据份额较少,市场中的大部分为以便宜得多的烃为基础的产品。由于配置成本高昂,2006年对含氟表面活性剂在涂料中的应用估值仅为1亿美元[185]。
农药
大约30%的农药都含有氟[199],大多数是除草剂与杀菌剂,还有一些是植物激素。与含氟医药相似,氟原子经常取代一个单独的原子或者最多一个三氟甲基官能团,这种改变可以增加在生物体内停留时间,增强细胞膜穿透能力,并且可以改变分子识别[200]。氟乐灵是一个突出的例子,该农药在美国大规模用作除草剂[200][201],但是怀疑它具有致癌作用,在许多欧洲国家都被禁止使用[202]。氟乙酸钠是一种哺乳动物毒剂,其中乙酸上的两个氢原子分别由氟和钠取代。在三羧酸循环过程中,该物质会取代乙酸从而干扰细胞新陈代谢。该物质首先与19世纪晚期合成,在20世纪早期发现了其杀虫剂的作用,随后开始使用。新西兰是该物质的最大消费者,用它来杀死来自澳大利亚的入侵物种刷尾负鼠以保护鹬鸵[203]。欧洲和美国都禁止使用氟乙酸钠[204][205][note 18]。
医疗应用
牙齿护理
_gives_a_Fluoride_treatment_to_a_patient_during_a_Continuing_Promise_2009_medical_civil_service_projec.jpg.webp)
20世纪中叶以来的研究表明,外用氟化物可以减少龋齿。最初研究认为这是由于牙釉质羟基磷灰石转变为了更耐磨的氟磷灰石,但是对预先氟化的牙齿的研究否定了这一假设。目前解释这一现象的理论是在龋齿较小时,氟化物能够促进牙釉质的生长[206]。在研究了生活在饮用水中存在天然氟化物的地区的儿童以后,1940年开始通过在公共供水中添加氟化物并控制其含量来防止龋齿[207]。目前全球人口的6%接受了氟化饮用水,而在美国这一比例更是达到了三分之二[208][209]。发表于2000年和2007年的学术文献综述认为,饮水氟化明显的降低了儿童中龋齿發生的概率[note 19]。尽管饮水氟化得到了学术研究的支持,除了良性的氟牙症外,并无显著副作用[212],在伦理和安全层面仍存在着针对饮水氟化的反对意见[209][213]。由于目前生活中存在着其它氟化物来源,饮水氟化的效果有所降低,但在低收入群体中仍存在可观测到的作用[214]。单氟磷酸钠以及氟化钠、氟化亚锡常常作为氟化牙膏的成分。1995年,美国首先使用这些物质,而目前在发达国家,氟化物在漱口水、凝胶、泡沫等,都有广泛应用[214][215]。
制药

20%的现代药物中都含有氟[216]。含氟药物阿托伐他汀在2011年成为通用名药物以前在所有药物中销售额居于榜首[217]。治疗哮喘的组合处方药物舒利迭,在2000年代中期销售额也排在前10,其中的两种活性成分之一氟替卡松也是一种氟化物[218]。由于碳氟键非常稳定,许多药物氟化是为了降低活跃度以延长给药周期[219]。由于碳氟键较碳氢键疏水性更强,氟化还能增加亲油性,这可以帮助药物穿过细胞膜,提高生物利用度[218]。
三环类抗抑郁药以及其他20世纪80年代早期的抗抑郁药因其无选择性的干扰除了羟色胺以外的神经递质而具有许多副作用。而氟化药物氟西汀则因其选择性而成为第一类能够避免这些问题的药物之一。目前许多抗抑郁药物都经过类似的氟化处理,包括选择性血清素再摄取抑制剂:酞普兰、其异构体依他普仑、以及氟伏沙明和帕罗西汀[220][221]。人造广谱抗生素喹诺酮类药物通常也会通过氟化来提高疗效。这些药物包括环丙沙星和左氧氟沙星[222][223][224][225]。在类固醇药物中也会使用氟[226]:氟氢可的松是可以使血压升高的盐皮质激素;去炎松与地塞米松是很强的糖皮质激素[227]。大多数吸入型麻醉剂都是重度氟化的。其原型氟烷在同时代药物中更为稳定与有效。后来诸如七氟醚、地氟醚等氟化醚化合物比氟烷更好,它们基本不溶于血液,可以使人更快清醒[228][229]。
PET扫描
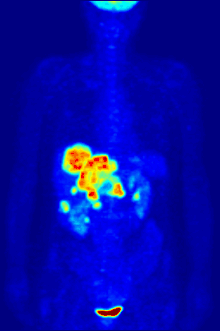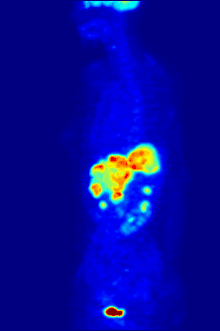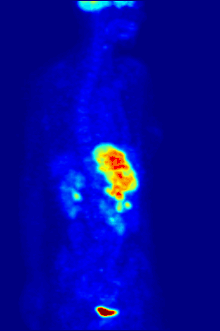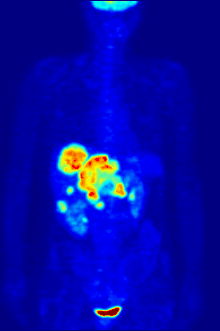
F PET扫描
18
F常作为正电子发射计算机断层扫描中的放射性示踪剂,其约两个小时的半衰期足够将其从生产设备运输至成像中心了[230]。氟代脱氧葡萄糖是最常用的示踪剂[230],在经过静脉注射后,会由诸如大脑和大多数恶性肿瘤等最消耗葡萄糖的器官组织吸收[231]。随后,计算机辅助断层扫描可以用来对细节成像[232]。
携带氧气
液体氟化碳可以携带比血液更多的氧气或者二氧化碳,因而在人工血和液体呼吸方面引起了很大的关注[233]。由于氟化碳正常情况下无法与水混合,必须将它们混合成为乳状液(全氟化碳小液滴悬浮于水中)以用作血液[234][235]。Oxycyte就是一种已经通过初步临床试验的人工血液产品[236]。这些物质可以提高运动员的耐力,因此在运动中禁止使用。1998年,一位濒临死亡的自行车运动员引起了对滥用人工血液的调查[237][238]。纯的全氟化碳液体呼吸的应用(使用的是纯全氟化碳液体,而不是与水混合的乳状液)包括辅助烧伤患者以及肺功能发育不全的早产儿。考虑的液体呼吸方案包括将肺部分填满或者全部填满,但是仅前者经过了人体测试[239]。制药联盟的努力使得该方案达到了临床测试的水平,但是由于实验结果并不比正常的治疗方案好,最终放弃了该方案[240]。
生物作用

氟并非人或者其它哺乳动物必须的元素。少量的氟可能对增加骨强度有益,但是该理论尚未确立。由于日常环境中有很多微量氟的来源,氟缺乏的可能性仅能通过人工饮食来实现[241][242]。在微生物和植物体内曾经发现过有机氟[61],但是在动物体内尚未发现[243]。最常见的天然有机氟产物是氟乙酸,可以帮助植物抵御食草动物。至少有40种植物含有该物质,这些植物分布在非洲、澳大利亚以及巴西[204]。其它的天然有机氟产物包括末端氟化脂肪酸、氟丙酮以及2-氟代柠檬酸[243]。2002年在细菌中发现了建立氟碳键的酶(腺苷甲硫氨酸氟化物合酶)[244]。
毒性
氟元素对生物活体有剧毒。氰化氢在浓度为50ppm时就会对人体产生影响,而氟所需要的浓度更低[246],影响与氯相似[247]:在浓度超过25ppm时对眼睛与呼吸系统有强烈刺激,对肝脏与肾脏可以造成损伤,这一浓度也是氟的即刻性损伤或致死浓度[248][249]。氟的浓度达到100ppm时,眼睛与鼻子将会受到严重损伤[248],若浓度达到1000ppm,数分钟的呼吸即可致命[250]。氰化氢的浓度达到270ppm即可使人在数分钟内死亡[251]。
氢氟酸
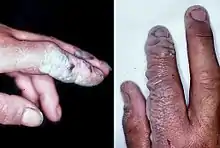
尽管氢氟酸是一种弱酸,它可以通过接触产生比诸如硫酸等强酸更严重的伤害。这一部分原因是因为它在水溶液是电中性的,故无论是通过呼吸道、消化道还是皮肤吸收的氟化氢都能迅速穿透组织。1984-1994年间,至少有9名美国工人死于与氢氟酸接触的事故中。氢氟酸可以与血液里的钙和镁发生反应,导致低钙血症,并且可能因心律失常导致死亡[253]。与氟化氢接触生成的不易溶解的氟化钙可以触发强烈的疼痛[254],若烧伤面积超过160平方厘米将导致严重的全身中毒[255]。
氢氟酸烧伤的症状可能在一开始时不明显,对于50%的溶液,需要8小时才有明显症状,对于更稀的溶液则或许需要24小时。因为氟化氢影响了神经功能,所以氢氟酸的烧伤病患可能在一开始时并无痛感。 当皮肤接触到氢氟酸时,及时用流水冲洗10-15分钟并移除被污染的衣物可以有效减少伤害。[256]通常,在进一步的处理中,会使用葡萄糖酸钙。其提供钙离子与氟离子形成不可溶的氟化钙。皮肤烧伤可以施用2.5%葡萄糖酸钙凝胶或者特制清洗溶液。[257][258][259]氢氟酸吸入需要进一步的治疗,可能需要静脉注射葡萄糖酸钙。但不可使用氯化钙,因为它可能造成更复杂的情况。可能需要切除或截除受侵染的部位。[255][260]
氟离子
可溶氟化物具有中等毒性,对于成人来说,氟化钠的致死剂量为5-10克,也就是说氟离子的致死剂量为32-64毫克每千克体重[261]。五分之一的致死剂量会对健康产生不利影响,而慢性的过量食用会导致氟骨症,这是一种影响了亚洲和非洲数百万人的疾病[262][263]。通过消化系统摄入氟化物会在胃内形成氢氟酸,而氢氟酸很容易被小肠吸收。在通过尿排出之前,它将穿过细胞膜,与钙结合并干扰多种酶的作用。接触极限值将通过检测人体排出氟离子的能力的尿检来确定[262][264]。
大多数氟中毒都是由于偶然摄入了含有无机氟化物的杀虫剂造成的[265]。而目前与氟中毒有关的打给毒药控制中心的电话多是由于摄入了含氟牙膏[262]。饮水加氟设备的故障是另一个氟中毒的原因,一次发生于阿拉斯加的事故导致近300人中毒,并且一人死亡[266]。牙膏带来的风险对幼年儿童尤其严重,因此疾病控制预防中心建议监督六岁以下的儿童刷牙以防止吞咽牙膏[267]。一个区域性调查研究调查了一年内发生的一共87件低于十岁的儿童氟中毒事件,其中包括了一起因摄入杀虫剂导致死亡的案例,除了30%的人胃痛,大多数都没有症状[265]。一项更大的覆盖全美的调查结论相似,80%的氟中毒案例都包含有低于6岁的儿童,几乎没有严重的案例[268]。
环境问题
大气层
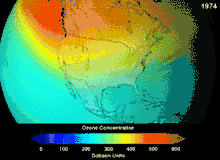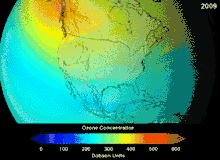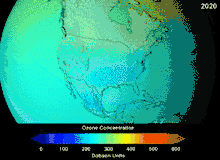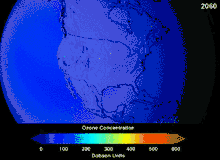
由于氯氟烃与溴氟烃的臭氧层破坏潜能,签署于1987年的蒙特利尔议定书对这两种物质的使用做出了严格规定。由于碳氟键的稳定性,这两种物质在到达海拔较高的平流层之前无法分解,而在平流层他们释放出来的氯原子与溴原子将攻击臭氧分子[270]。有预测警告说,尽管有了禁令,臭氧层全面恢复仍需要数代人的时间[271][272]。目前氢氯氟烃成为氯氟烃的替代品,其臭氧层破坏潜能仅为氯氟烃的10%[273],并且计划到2030-2040年,将以不含氯、不会破坏臭氧层的氢氟烃替换氢氯氟烃[274]。2007年要求发达国家将该替换日期提前至2020年[275]。美国国家环境保护局已经在2003年禁止了氢氯氟烃的生产[274]。气体氟碳化合物通常是温室气体,其全球暖化潜能约为100至10000。六氟化硫的全球暖化潜能约为20000[276]。HFO-1234yf的全球暖化潜能为4,远远小于潜能为1340的标准制冷剂HFC-134a,因而吸引了全球的需求[188]。
生物持久性
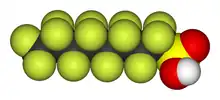
由于碳氟键很强,有机氟化物具有较长的生物持久性。由于其酸性官能团而不易溶于水的全氟烷磺酸就是持久性有机污染物[278]。全氟辛烷磺酸与全氟辛酸是最常研究的物质[279][280][281]。全氟烷磺酸在全世界的生物体内都能发现其踪迹,从北极熊到人类,而已知全氟辛烷磺酸与全氟辛酸存在于母乳和新生儿的血液中。一项2013年的调查表明,地下水与土壤中的全氟烷磺酸与人类活动有一些相关性,但是并没有明确的结果表明哪一种化学物质会占主导地位;较高的全氟辛烷磺酸和较高全氟辛酸呈现相关性[279][280][282]。在人体内,全氟烷磺酸会与诸如血清白蛋白等的蛋白质相结合,并且具有在通过肾脏排出之前在人体内的肝脏和血液中聚集的趋势[279][280][283]。大剂量的全氟辛烷磺酸和全氟辛酸可以导致癌症,并且导致新生幼鼠的死亡,但是还没有关于在当前的暴露水平下其对人影响的人体研究。[279][280][283]
注释
- 来源对氧、氟和氖的共价半径有争议,因此不能精确比较。
- α相的氟的分子具有规则排列,是一种晶体,但是其分子没有特定的取向。β相的氟分子具有固定位置和最小的旋转不确定度。参见[43]以了解α相氟晶体结构的一些细节。[44][45]
- 相变过程会产生巨响,并使样本和容器破裂。
- 磁矩与角动量之比称为磁旋比。原子核经常可以不严格的想象为绕着一个轴自转的带电陀螺,通常这种自旋会带给原子核角动量和磁矩。角动量来自于原子核的质量,而磁矩则来自于旋转的全部或者部分电荷。[47]
- 巴希尔·瓦伦丁可能在15世纪末就描述了萤石,但由于这篇文章直到200年后才被发现而存疑。[66][67][68]
- 另说1670年,Partington[72]和Weeks[71]给出不同的说法。
- Fl从2012年起表示第114号元素鈇。
- 汉弗里·戴维、约瑟夫·路易·盖-吕萨克、路易斯·贾奎斯·瑟纳德和爱尔兰化学家aThomas和George Knox都因此受伤,而比利时化学家Paulin Louyet和法国化学家Jérôme Nicklès则死于氟。莫瓦桑也经历过严重的氢氟酸中毒。[71][81]
- 同时他也因他发明的电弧炉而获奖。
- F
2中的氟被定义为具有氧化数0。不稳定的F−
2 和 F−
3具有中间氧化态,它们在40 K即分解[92]。F+
4以及其它一些类似的物质据预测为稳定的[93]。 - 亚稳态的一氟化硼和一氟化氮具有更高阶的共价键,一些金属络合物使用其作为桥接配体。氢键是另一个可能性。
- ZrF
4的熔点为932 °C(1,710 °F)[106],HfF
4在968 °C(1,774 °F)下升华[103],UF
4的熔点为1,036 °C(1,897 °F)。[107] - 这13种金属元素为钼、锝、钌、铑、钨、铼、锇、铱、铂、钋、铀、镎和钚。
- 参见这个参考资料。[125]
- 四氟化碳形式上是有机化合物,但为了与SiF
4和GeF
4比较而被包括到这个章节中,而不是我们讨论更复杂的化合物的有机化合物章节。 - 有机全氟化物十分稳定,但单氟化物的反应性相对活泼
- 该术语并不精确,全氟化物质也是常用的术语。[155]
- 美国的羊和牛可能还会使用氟乙酸钠来对付郊狼等掠食者。
- [210],另见总结[211]
参考文献
- Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. . Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- Jaccaud 2000,第381頁.
- Jaccaud 2000,第382頁.
- Compressed Gas Association. . Springer. 1999: 365. ISBN 9780412782305.
- Dean 1999,第3.29頁.
- Haynes, William M. (编). 92nd. Boca Raton: CRC Press. 2011: 4.121. ISBN 978-1-4398-5511-9.
- Himmel, D.; Riedel, S. . Inorganic Chemistry. 2007, 46 (13). 5338–5342. doi:10.1021/ic700431s.
- Dean 1999,第4.6頁.
- Dean 1999,第4.35頁.
- Kim, Sung-Hoon. . Elsevier. 2006: 257. ISBN 9780444521767.
- Mackay, Mackay & Henderson 2002,第72頁.
- Yaws, Carl L.; Braker, William. . 7th. Parsippany: Matheson Tri-Gas. 2001: 385. ISBN 978-0-07-135854-5.
- Lee, Stephen; et al. . Journal of Agricultural and Food Chemistry (ACS Publications). 2014, 62 (30): 7345–7354. PMID 24724702. doi:10.1021/jf500563h.
- Dean 1999,第564頁.
- Lide 2004,第10.137–10.138頁.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. . Belmont: Brooks/Cole. 2010: 156. ISBN 978-0-495-39079-4.
- Cordero, B.; Gómez, V.; Platero-Prats, A. E.; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Alvarez, S. . Dalton Transactions. 2008, (21): 2832–2838. PMID 18478144. doi:10.1039/b801115j.
- Pyykkö, Pekka; Atsumi, Michiko. . Chemistry: A European Journal. 2009, 15 (46): 12770–9. PMID 19856342. doi:10.1002/chem.200901472.
- Greenwood & Earnshaw 1998,第804頁.
- Macomber, Roger. 1. Sausalito: University Science Books. 1996: 230. ISBN 978-0-935702-90-3.
- Nelson, Eugene W. . Popular Mechanics. 1947, 88 (2): 106–108, 260 [2022-10-21]. (原始内容存档于2023-07-22).
- Lidin, Molochko & Andreeva 2000,第442–455頁.
- Wiberg, Wiberg & Holleman 2001,第404頁.
- Patnaik 2007,第472頁.
- Aigueperse 2000,第400頁.
- Greenwood & Earnshaw 1998,第76, 804頁.
- Kuriakose, A. K.; Margrave, J. L. . Journal of Physical Chemistry. 1965, 69 (8): 2772–2775. doi:10.1021/j100892a049.
- Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. . Journal of Fluorine Chemistry. 2007, 128 (1): 17–28. S2CID 95754841. doi:10.1016/j.jfluchem.2006.09.002. hdl:10098/1665
 .
. - Lagow, R. J. (PDF) (学位论文). Ann Arbor: UMI: 64–78. 1970 [2022-10-21]. (原始内容存档 (PDF)于2020-07-26).
- Lidin, Molochko & Andreeva 2000,第252頁.
- Tanner Industries. . tannerind.com. January 2011 [2013-10-24]. (原始内容存档于2020-08-06).
- Morrow, S. I.; Perry, D. D.; Cohen, M. S. . Journal of the American Chemical Society. 1959, 81 (23): 6338–6339. doi:10.1021/ja01532a066.
- Emeléus, H. J.; Sharpe, A. G. 16. New York: Academic Press. 1974: 111. ISBN 978-0-08-057865-1.
- Wiberg, Wiberg & Holleman 2001,第457頁.
- Brantley, L. R. Squires, Roy; Clarke, Arthur C. , 编. . Pacific Rockets: Journal of the Pacific Rocket Society (South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library). 1949, 3 (1): 26. ISBN 978-0-9794418-5-1.
- Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. . Nature. 2000, 406 (6798): 874–876 [2022-10-21]. Bibcode:2000Natur.406..874K. PMID 10972285. S2CID 4382128. doi:10.1038/35022551. (原始内容存档于2016-04-13).
- Burdon, J.; Emson, B.; Edwards, A. J. . Journal of Fluorine Chemistry. 1987, 34 (3–4): 471–474. doi:10.1016/S0022-1139(00)85188-X.
- Lide 2004,第4.12頁.
- Dean 1999,第523頁.
- Young, David A. (PDF) (报告). Lawrence Livermore Laboratory. 1975 [2011-06-10]. (原始内容存档于2020-08-13).
- Barrett, C. S.; Meyer, L.; Wasserman, J. . The Journal of Chemical Physics. 1967, 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
- Pauling, L.; Keaveny, I.; Robinson, A. B. . Journal of Solid State Chemistry. 1970, 2 (2): 225–227. Bibcode:1970JSSCh...2..225P. doi:10.1016/0022-4596(70)90074-5.
- Bürgi, H. B. . Annual Review of Physical Chemistry. 2000, 51: 275–296. Bibcode:2000ARPC...51..275B. PMID 11031283. doi:10.1146/annurev.physchem.51.1.275.
- Müller, Peter. (PDF). Cambridge: MIT OpenCourseWare. 2009 [2013-10-13]. (原始内容存档 (PDF)于2020-08-06).
- Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- Vigoureux, P. . Contemporary Physics. 1961, 2 (5): 360–366. Bibcode:1961ConPh...2..360V. S2CID 5092147. doi:10.1080/00107516108205282.
- Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. . Weinheim: Wiley-VCH: 752, 754. 2012. doi:10.1002/14356007.b05_471.
- Cameron, A. G. W. (PDF). Space Science Reviews. 1973, 15 (1): 121–146. Bibcode:1973SSRv...15..121C. S2CID 120201972. doi:10.1007/BF00172440. (原始内容 (PDF)存档于2011-10-21).
- Croswell, Ken. . Sky and Telescope. September 2003 [2013-10-17]. (原始内容存档于2016-03-04).
- Clayton, Donald. . New York: Cambridge University Press. 2003: 101-104. ISBN 978-0-521-82381-4.
- Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Katia; Smith, Verne V. . Monthly Notices of the Royal Astronomical Society. 2004, 354 (2): 575–580. Bibcode:2004MNRAS.354..575R. S2CID 12330666. arXiv:astro-ph/0410580
 . doi:10.1111/j.1365-2966.2004.08215.x.
. doi:10.1111/j.1365-2966.2004.08215.x. - Jaccaud 2000,第384頁.
- Schulze-Makuch, D.; Irwin, L. N. 2nd. Berlin: Springer-Verlag. 2008: 121. ISBN 978-3-540-76816-6.
- Haxel, G. B.; Hedrick, J. B.; Orris, G. J. Stauffer, P. H.; Hendley II, J. W. , 编. (报告). U.S. Geological Survey. 2005 [2014-01-31]. (原始内容存档于2020-07-19).
- Greenwood & Earnshaw 1998,第795頁.
- Norwood, Charles J.; Fohs, F. Julius. . Kentucky Geological Survey. 1907: 52.
- Villalba, Gara; Ayres, Robert U.; Schroder, Hans. . Journal of Industrial Ecology. 2008, 11: 85–101. S2CID 153740615. doi:10.1162/jiec.2007.1075.
- Kelly, T. D.; Miller, M. M. . U.S. Geological Service. 2005 [2014-02-10]. (原始内容存档于2013-05-22).
- Lusty, P. A. J.; Brown, T. J.; Ward, J.; Bloomfield, S. . British Geological Survey. 2008 [2013-10-13]. (原始内容存档于2016-08-07).
- Gribble, G. W. . Neison, A. H. (编). . The Handbook of Environmental Chemistry 3N. Berlin: Springer. 2002: 121–136. ISBN 3-540-42064-9. doi:10.1007/10721878_5.
- Richter, M.; Hahn, O.; Fuchs, R. . Studies in Conservation. 2001, 46 (1): 3. JSTOR 1506878. S2CID 191611885. doi:10.1179/sic.2001.46.1.1.
- Schmedt Auf Der Günne, Jörn; Mangstl, Martin; Kraus, Florian. . Angewandte Chemie International Edition. 2012, 51 (31): 7847–7849. ISSN 1521-3773. PMID 22763992. doi:10.1002/anie.201203515.
- Greenwood & Earnshaw 1998,第790頁.
- Senning, A. . Amsterdam and Oxford: Elsevier. 2007: 149. ISBN 978-0-444-52239-9.
- Stillman, John Maxson. . Popular Science Monthly. December 1912, 81 [2013-10-14]. (原始内容存档于2023-07-22).
- Principe, Lawrence M. . Chicago: University of Chicago Press. 2012: 140, 145. ISBN 978-0-226-68295-2.
- Agricola, Hoover & Hoover 1912,footnotes and commentary, pp. xxx, 38, 409, 430, 461, 608.
- Greenwood & Earnshaw 1998,第109頁.
- Agricola, Hoover & Hoover 1912,preface, pp. 380–381.
- Weeks, M. E. . Journal of Chemical Education. 1932, 9 (11): 1915–1939. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- Partington, J. R. . Memoirs and Proceedings of the Manchester Literary and Philosophical Society. 1923, 67 (6): 73–87.
- Marggraf, Andreas Sigismun. [Observation of a remarkable volatilization of part of a type of stone to which one gives the name flosse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l'Académie royale des sciences et belles-lettres. 1770, XXIV: 3–11 (法语).
- Kirsch 2004,第3–10頁.
- Scheele, Carl Wilhelm. [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science]. 1771, 32: 129–138 (瑞典语).
- Ampère, André-Marie. . Annales de chimie et de physique. 1816, 2: 1–5 (法语).
- Davy, Humphry. . Philosophical Transactions of the Royal Society. 1813, 103: 278. doi:10.1098/rstl.1813.0034
 .
. - Banks, R. E. . Journal of Fluorine Chemistry. 1986, 33 (1–4): 3–26. doi:10.1016/S0022-1139(00)85269-0.
- Storer, Frank H. . Cambridge: Sever and Francis. 1864: 278–280.
- 劉懷樂. . 化學教育. 1994, (04) [2013-02-25]. (原始内容存档于2013-10-04).
- Toon, Richard. . Education in Chemistry. Vol. 48 no. 5 (Royal Society of Chemistry). 2011-09-01: 148–151 [2022-10-23]. ISSN 0013-1350. (原始内容存档于2019-03-29).
- Asimov, Isaac. . New York: Basic Books. 1966: 162. ISBN 978-0-465-05129-8.
- Greenwood & Earnshaw 1998,第789–791頁.
- Moissan, Henri. . Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1886, 102: 1543–1544 [2013-10-09]. (原始内容存档于2020-08-06) (法语).
- Viel, Claude; Goldwhite, Harold. . Laylin, K. James (编). . Washington: American Chemical Society; Chemical Heritage Foundation. 1993: 35. ISBN 978-0-8412-2690-6.
- Okazoe, T. . Proceedings of the Japan Academy, Series B. 2009, 85 (8): 276–289 [2022-10-23]. Bibcode:2009PJAB...85..276O. PMC 3621566
 . PMID 19838009. doi:10.2183/pjab.85.276. (原始内容存档于2020-08-06).
. PMID 19838009. doi:10.2183/pjab.85.276. (原始内容存档于2020-08-06). - Hounshell, David A.; Smith, John Kelly. . Cambridge: Cambridge University Press. 1988: 156–157. ISBN 0-521-32767-9.
- DuPont. . 2013a [2013-10-17]. (原始内容存档于2015-02-21).
- Meyer, Eugene. . Englewood Cliffs: Prentice Hall. 1977: 111. ISBN 978-0-13-129239-0.
- Kirsch 2004,第60–66頁.
- Riedel, Sebastian; Kaupp, Martin. . Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- Wiberg, Wiberg & Holleman 2001,第422頁.
- Schlöder, T.; Riedel, S. . RSC Advances (Royal Society of Chemistry). 2012, 2 (3): 876–881. Bibcode:2012RSCAd...2..876S. doi:10.1039/C1RA00804H.
- Harbison, G. S. . Journal of the American Chemical Society. 2002, 124 (3): 366–367. PMID 11792193. doi:10.1021/ja0159261.
- Edwards, Philip Neil. . Banks, R. E.; Smart, B. E.; Tatlow, J. C. (编). . New York: Plenum Press. 1994: 515. ISBN 978-0-306-44610-8.
- Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo. . Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. (编). . Tokyo: Kodansha. 1999: 267. ISBN 4-06-208635-2.
- Aigueperse 2000,第420–422頁.
- Walsh, Kenneth A. . Materials Park: ASM International. 2009. ISBN 978-0-87170-721-5.
- Emeléus & Sharpe 1983,第89–97頁.
- Babel, Dietrich; Tressaud, Alain. . Hagenmuller, Paul (编). . Orlando: Academic Press. 1985: 91–96. ISBN 978-0-12-412490-5.
- Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. . Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, 4: 478–482. doi:10.1039/J19670000478.
- Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam. . Amsterdam: Elsevier B. V. 2005: 144. ISBN 978-0-444-51803-3.
- Perry, Dale L. 2nd. Boca Raton: CRC Press. 2011: 193. ISBN 978-1-4398-1461-1.
- Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. . The Journal of Chemical Physics. 1994, 101 (11): 9333–9337 [2022-11-04]. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963. (原始内容存档于2021-04-14).
- Lide 2004,第4.60, 4.76, 4.92, 4.96頁.
- Lide 2004,第4.96頁.
- Lide 2004,第4.92頁.
- Greenwood & Earnshaw 1998,第964頁.
- Becker, S.; Müller, B. G. . Angewandte Chemie International Edition in English. 1990, 29 (4): 406–407. doi:10.1002/anie.199004061.
- Greenwood & Earnshaw 1998,第990頁.
- Lide 2004,第4.72, 4.91, 4.93頁.
- Greenwood & Earnshaw 1998,第561–563頁.
- Emeléus & Sharpe 1983,第256–277頁.
- Mackay, Mackay & Henderson 2002,第355–356頁.
- Greenwood & Earnshaw 1998,看对应金属的页面.
- Lide 2004,第4.71, 4.78, 4.92頁.
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. . Inorganic Chemistry. 2006, 45 (9): 3782–3788. PMID 16634614. doi:10.1021/ic052029f.
- Greenwood & Earnshaw 1998,第819頁.
- Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. . Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, 4: 478–482. doi:10.1039/J19670000478.
- Pauling, Linus.
 3rd. Ithaca: Cornell University Press. 1960: 454–464. ISBN 978-0-8014-0333-0.
3rd. Ithaca: Cornell University Press. 1960: 454–464. ISBN 978-0-8014-0333-0. - Atkins, Peter; Jones, Loretta.
 4th. New York: W. H. Freeman. 2007: 184–185. ISBN 978-1-4292-0965-6.
4th. New York: W. H. Freeman. 2007: 184–185. ISBN 978-1-4292-0965-6. - Emsley, John. . New Scientist. 1981, 91 (1264): 291–292 [2024-01-18]. (原始内容存档于2023-07-22).
- Greenwood & Earnshaw 1998,第812–816頁.
- Wiberg, Wiberg & Holleman 2001,第425頁.
- Clark, Jim. . chemguide.co.uk. 2002 [2013-10-15]. (原始内容存档于2012-05-31).
- Chambers, C.; Holliday, A. K. (PDF). London: Butterworth & Co. 1975: 328–329. ISBN 978-0-408-70663-6. (原始内容 (PDF)存档于2013-03-23).
- Air Products and Chemicals. (PDF). Air Products and Chemicals: 1. 2004 [2014-02-16]. (原始内容 (PDF)存档于2006-03-18).
- Noury, S.; Silvi, B.; Gillespie, R. J. (PDF). Inorganic Chemistry. 2002, 41 (8): 2164–2172 [2012-05-23]. PMID 11952370. doi:10.1021/ic011003v. (原始内容存档于2020-05-11).
- Chang, Raymond; Goldsby, Kenneth A. 11th. New York: McGraw-Hill. 2013: 706. ISBN 978-0-07-131787-0.
- Ellis, Brian. . Cambridge: Cambridge University Press. 2001: 69. ISBN 978-0-521-80094-5.
- Aigueperse 2000,第423頁.
- Wiberg, Wiberg & Holleman 2001,第897頁.
- Raghavan, P. S. . Delhi: Discovery Publishing House. 1998: 164–165. ISBN 978-81-7141-418-5.
- Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. . Norman, Nicholas C. (编). . London: Blackie Academic & Professional. 1998: 98. ISBN 978-0-7514-0389-3.
- Aigueperse 2000,第432頁.
- Murthy, C. Parameshwara; Mehdi Ali, S. F.; Ashok, D. I. New Delhi: New Age International. 1995: 180–182, 206–208. ISBN 978-81-224-0742-6.
- Greenwood & Earnshaw 1998,第638–640, 683–689, 767–778頁.
- Wiberg, Wiberg & Holleman 2001,第435–436頁.
- Greenwood & Earnshaw 1998,第828–830頁.
- Patnaik 2007,第478–479頁.
- Moeller, T.; Bailar, J. C.; Kleinberg. 3rd. New York: Academic Press. 1980: 236. ISBN 0-12-503350-8.
- Wiberg, Wiberg & Holleman 2001,第392–393頁.
- Wiberg, Wiberg & Holleman 2001,第395–397, 400頁.
- Lewars 2008,第68頁.
- Pitzer, Kenneth S. (编). . Singapore: World Scientific Publishing. 1993: 111. ISBN 978-981-02-1439-5.
- Lewars 2008,第67頁.
- Bihary, Z.; Chaban, G. M.; Gerber, R. B. . The Journal of Chemical Physics. 2002, 117 (11): 5105–5108. Bibcode:2002JChPh.117.5105B. doi:10.1063/1.1506150.
- Lewars 2008,第71頁.
- Hoogers, G. . Hoogers, G. (编). . Boca Raton: CRC Press. 2002: 4-12. ISBN 0-8493-0877-1.
- O'Hagan, D. . Chemical Society Reviews. 2008, 37 (2): 308–319. PMID 18197347. doi:10.1039/b711844a.
- Siegemund 2005,第444頁.
- Sandford, Graham. . Philosophical Transactions. 2000, 358 (1766): 455. Bibcode:2000RSPTA.358..455S. S2CID 202574641. doi:10.1098/rsta.2000.0541.
- Siegemund 2005,第451–452頁.
- Barbee, K.; McCormack, K.; Vartanian, V. . Mendicino, L. (编). . Pennington, NJ: The Electrochemical Society. 2000: 116. ISBN 978-1-56677-230-3.
- Posner, Stefan; et al. (PDF). Copenhagen: Nordic Council of Ministers. 2013: 187–190 [2024-01-18]. ISBN 978-92-893-2562-2. doi:10.6027/TN2013-542. (原始内容存档 (PDF)于2023-07-09).
- Posner, Stefan. . Knepper, Thomas P.; Large, Frank T. (编). . Heidelberg: Springer Science+Business Media. 2011: 27. ISBN 978-3-642-21871-2.
- Salager, Jean-Louis. (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. 2002: 45 [2013-10-13]. (原始内容 (PDF)存档于2020-07-31).
- Carlson & Schmiegel 2000,第3頁.
- Carlson & Schmiegel 2000,第3–4頁.
- Rhoades, David Walter. (PhD dissertation, University of Southern Mississippi, MS). Ann Arbor. 2008: 2. ISBN 978-0-549-78540-8.
- Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. . Electrochimica Acta. 1998, 43 (24): 3741–3747. doi:10.1016/S0013-4686(98)00132-7.
- Carlson & Schmiegel 2000,第4頁.
- Jaccaud 2000,第386頁.
- Jaccaud 2000,第384–385頁.
- Jaccaud 2000,第390–391頁.
- Shriver, Duward; Atkins, Peter. . New York: W. H. Freeman. 2010: 427. ISBN 978-1-4292-5255-3.
- Christe, Karl O. . Inorganic Chemistry. 1986, 25 (21): 3721–3722. doi:10.1021/ic00241a001.
- Christe Research Group. . n.d. [2013-01-12]. (原始内容存档于2016-03-04).
- Carey, Charles W. . Santa Barbara: ABC-CLIO. 2008: 173. ISBN 978-1-85109-998-6.
- Miller, M. Michael. (PDF). U.S. Geological Survey. 2003 [2013-10-24]. (原始内容存档 (PDF)于2017-02-17).
- PRWeb. . prweb.com. 2012-02-23 [2013-10-24]. (原始内容存档于2020-07-31).
- Bombourg, Nicolas. . Reporterlinker. 2012-07-04 [2013-10-20]. (原始内容存档于2020-04-23).
- Transparency Market Research. . Transparency Market Research Blog. 2013-05-17 [2013-10-15]. (原始内容存档于2014-02-22).
- Fulton, Robert B.; Miller, M. Michael. . Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. (编). . Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). 2006: 471. ISBN 978-0-87335-233-8.
- Jaccaud 2000,第392頁.
- Aigueperse 2000,第430頁.
- Jaccaud 2000,第391–392頁.
- El-Kareh, Badih. . Norwell and Dordrecht: Kluwer Academic Publishers. 1994: 317. ISBN 978-0-7923-9534-8.
- Arana, L. R.; Mas, N.; Schmidt, R.; Franz, A. J.; Schmidt, M. A.; Jensen, K. F. . Journal of Micromechanics and Microengineering. 2007, 17 (2): 384–392. Bibcode:2007JMiMi..17..384A. S2CID 135708022. doi:10.1088/0960-1317/17/2/026.
- Miller, M. Michael. (PDF). . U.S. Geological Survey. 2003: 27.1–27.12 [2023-11-19]. (原始内容存档 (PDF)于2004-11-01).
- Energetics, Inc. (PDF) (报告): 41, 50. 1997 [2013-10-15].
- Aigueperse 2000,第428頁.
- Willey, Ronald R. . Charlevoix: Willey Optical. 2007: 113. ISBN 978-0-615-14397-2.
- PRWeb. . prweb.com. 2010-10-28 [2013-10-24]. (原始内容存档于2020-07-31).
- Renner, R. . Environmental Science & Technology. 2006, 40 (1): 12–13. Bibcode:2006EnST...40...12R. PMID 16433328. doi:10.1021/es062612a
 .
. - Green, S. W.; Slinn, D. S. L.; Simpson, R. N. F.; Woytek, A. J. . Banks, R. E.; Smart, B. E.; Tatlow, J. C. (编). . New York: Plenum Press. 1994: 91–93. ISBN 978-0-306-44610-8.
- DuPont. . 2013b [2013-10-17]. (原始内容存档于2014-10-03).
- Walter, P. . Chemistry World. 2013 [2024-01-18]. (原始内容存档于2016-03-04).
- Buznik, V. M. . Russian Journal of General Chemistry. 2009, 79 (3): 520–526. S2CID 97518401. doi:10.1134/S1070363209030335.
- PRWeb. . prweb.com. 2013-04-07 [2013-10-24]. (原始内容存档于2020-07-31).
- Martin, John W. (编). . Oxford and Amsterdam: Elsevier. 2007: 187–194. ISBN 978-0-08-045127-5.
- DeBergalis, Michael. . Journal of Fluorine Chemistry. 2004, 125 (8): 1255–1257. doi:10.1016/j.jfluchem.2004.05.013.
- Grot, Walter. 2nd. Oxford and Waltham: Elsevier. 2011: 1–10. ISBN 978-1-4377-4457-6.
- Ramkumar, Jayshree. . Banerjee, S.; Tyagi, A. K. (编). . London and Waltham: Elsevier. 2012: 567. ISBN 978-0-12-385142-0.
- Burney, H. . Burney, H. S.; Furuya, N.; Hine, F.; Ota, K.-I. (编). . Pennington: The Electrochemical Society. 1999: 111. ISBN 1-56677-244-3.
- Slye, Orville M. . Ullmann, Franz (编). 15. Weinheim: Wiley-VCH. 2012: 10. ISBN 978-3527306732. doi:10.1002/14356007.a11_113.pub2.
- Kissa, Erik. 2nd. New York: Marcel Dekker. 2001: 516–551. ISBN 978-0-8247-0472-8.
- Ullmann, Fritz. . Weinheim: Wiley-VCH. 2008: 538, 543–547. ISBN 978-3-527-31772-1.
- ICIS. . Reed Business Information. 2006-10-02 [2013-10-24]. (原始内容存档于2009-02-26).
- Theodoridis, George. . Tressaud, Alain (编). . Amsterdam and Oxford: Elsevier. 2006: 121–176. ISBN 978-0-444-52672-4.
- United States Environmental Protection Agency. (PDF). 1996 [2013-10-17]. (原始内容 (PDF)存档于2013-10-18).
- Directorate-General for the Environment (European Commission). (PDF) (报告). European Commission. 2007 [2013-10-14]. (原始内容存档于2020-07-28).
- Beasley, Michael. (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). August 2002 [2013-11-11]. ISBN 0-477-03664-3. (原始内容 (PDF)存档于2013-11-11).
- Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. . Toxicological Reviews. 2006, 25 (4): 213–219. PMID 17288493. S2CID 29189551. doi:10.2165/00139709-200625040-00002.
- Eisler, Ronald. (PDF) (报告). Patuxent Environmental Science Center (U.S. National Biological Service). 1995 [2011-06-05]. (原始内容存档 (PDF)于2020-03-07).
- Pizzo, G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. (PDF). Clinical Oral Investigations. 2007, 11 (3): 189–193 [2023-02-23]. PMID 17333303. S2CID 13189520. doi:10.1007/s00784-007-0111-6. (原始内容存档 (PDF)于2020-07-24).
- Centers for Disease Control and Prevention. . MMWR Recommendations and Reports. 2001, 50 (RR–14): 1–42 [2013-10-14]. PMID 11521913. (原始内容存档于2007-02-08).
- Ripa, L. W. (PDF). Journal of Public Health Dentistry. 1993, 53 (1): 17–44. PMID 8474047. doi:10.1111/j.1752-7325.1993.tb02666.x. (原始内容 (PDF)存档于2009-03-04).
- Cheng, K. K.; Chalmers, I.; Sheldon, T. A. (PDF). BMJ. 2007, 335 (7622): 699–702 [2012-03-26]. PMC 2001050
 . PMID 17916854. doi:10.1136/bmj.39318.562951.BE. (原始内容 (PDF)存档于2016-03-03).
. PMID 17916854. doi:10.1136/bmj.39318.562951.BE. (原始内容 (PDF)存档于2016-03-03). - National Health and Medical Research Council. (PDF). Canberra: Australian Government. 2007 [2013-10-08]. ISBN 978-1-86496-421-9. (原始内容 (PDF)存档于2012-01-13).
- Yeung, C. A. . Evidence-Based Dentistry. 2008, 9 (2): 39–43. PMID 18584000. doi:10.1038/sj.ebd.6400578
 .
. - Marya, C. M. . New Delhi: Jaypee Brothers Medical Publishers. 2011: 343. ISBN 978-93-5025-216-1.
- Armfield, J. M. . Australia and New Zealand Health Policy. 2007, 4: 25 [2023-02-28]. PMC 2222595
 . PMID 18067684. doi:10.1186/1743-8462-4-25. (原始内容存档于2016-01-27).
. PMID 18067684. doi:10.1186/1743-8462-4-25. (原始内容存档于2016-01-27). - Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian. . Fejerskov, Ole; Kidd, Edwina (编). 2nd. Oxford: Blackwell Munksgaard. 2008: 518. ISBN 978-1-4051-3889-5.
- Cracher, Connie M. (PDF). dentalcare.com: 12. 2012 [2013-10-14]. (原始内容 (PDF)存档于2013-10-14).
- Emsley 2011,第178頁.
- Johnson, Linda A. . The Boston Globe. 2011-12-28 [2013-10-24].
- Swinson, Joel. (PDF). PharmaChem (Pharmaceutical Chemistry). June 2005: 26–27 [2013-10-09]. (原始内容 (PDF)存档于2012-02-08).
- Hagmann, W. K. . Journal of Medicinal Chemistry. 2008, 51 (15): 4359–4369. PMID 18570365. doi:10.1021/jm800219f.
- Mitchell, E. Siobhan.
 . New York: Chelsea House Publishers. 2004: 37–39. ISBN 978-1-4381-0192-7.
. New York: Chelsea House Publishers. 2004: 37–39. ISBN 978-1-4381-0192-7. - Preskorn, Sheldon H. . Caddo: Professional Communications. 1996. ISBN 978-1-884735-08-0.
- Werner, N. L.; Hecker, M. T.; Sethi, A. K.; Donskey, C. J. . BMC Infectious Diseases. 2011, 11: 187–193. PMC 3145580
 . PMID 21729289. doi:10.1186/1471-2334-11-187.
. PMID 21729289. doi:10.1186/1471-2334-11-187. - Brody, Jane E. . The New York Times Well Blog. 2012-09-10 [2013-10-18].
- Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. (PDF). Clinical Infectious Diseases. 2007, 44 (7): 977–980 [2023-12-08]. PMID 17342653. doi:10.1086/512369
 . (原始内容存档 (PDF)于2022-09-01).
. (原始内容存档 (PDF)于2022-09-01). - King, D. E.; Malone, R.; Lilley, S. H. . American Family Physician. 2000, 61 (9): 2741–2748 [2013-10-08]. PMID 10821154.
- Parente, Luca. . Goulding, Nicolas J.; Flower, Rod J. (编). . Basel: Birkhäuser. 2001: 40. ISBN 978-3-7643-6059-7.
- Raj, P. Prithvi; Erdine, Serdar. . Chichester: John Wiley & Sons. 2012: 58. ISBN 978-0-470-67038-5.
- Filler, R.; Saha, R. (PDF). Future Medicinal Chemistry. 2009, 1 (5): 777–791. PMID 21426080. doi:10.4155/fmc.09.65. (原始内容 (PDF)存档于2013-10-22).
- Bégué, Jean-Pierre; Bonnet-Delpon, Danièle. . Hoboken: John Wiley & Sons. 2008: 335–336. ISBN 978-0-470-27830-7..
- Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (PDF). Journal of Spinal Disorders. 2000, 13 (6): 541–544 [2013-10-08]. PMID 11132989. doi:10.1097/00002517-200012000-00016. (原始内容存档 (PDF)于2020-05-08).
- Bustamante, E.; Pedersen, P. L. . Proceedings of the National Academy of Sciences. 1977, 74 (9): 3735–3739. Bibcode:1977PNAS...74.3735B. PMC 431708
 . PMID 198801. doi:10.1073/pnas.74.9.3735
. PMID 198801. doi:10.1073/pnas.74.9.3735  .
. - Alavi, Abbas; Huang, Steve S. . Hayat, M. A. (编). . Burlington: Academic Press. 2007: 41. ISBN 978-0-12-370468-9.
- Gabriel, J. L.; Miller, T. F. Jr.; Wolfson, M. R.; Shaffer, T. H. . ASAIO Journal. 1996, 42 (6): 968–973. PMID 8959271. S2CID 31161098. doi:10.1097/00002480-199642060-00009.
- Sarkar, S. . Indian Journal of Critical Care Medicine. 2008, 12 (3): 140–144. PMC 2738310
 . PMID 19742251. doi:10.4103/0972-5229.43685.
. PMID 19742251. doi:10.4103/0972-5229.43685. - Schimmeyer, S. . Illumin (Columbia: University of Southern Carolina). 2002, 15 (1) [2013-10-15]. (原始内容存档于2011-10-02).
- Davis, Nicole. . Popular Science. November 2006 [2013-10-20]. (原始内容存档于2011-06-04).
- Gains, Paul. . The New York Times. 1998-10-18 [2013-10-18]. (原始内容存档于2023-04-07).
- Taber, Andrew. . Salon. 1999-04-22 [2013-10-18]. (原始内容存档于2018-11-06).
- Shaffer, T. H.; Wolfson, M. R.; Clark, L. C. Jr. . Pediatric Pulmonology. 1992, 14 (2): 102. PMID 1437347. S2CID 222167378. doi:10.1002/ppul.1950140208.
- Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. . American Journal of Respiratory and Critical Care Medicine. 2006, 173 (8): 882–9. PMID 16254269. doi:10.1164/rccm.200508-1196OC.
- Nielsen, Forrest H. . Gastroenterology. 2009, 137 (5): S55–60 [2018-04-29]. PMID 19874950. doi:10.1053/j.gastro.2009.07.072
 . (原始内容存档于2020-07-30).
. (原始内容存档于2020-07-30). - Olivares, M.; Uauy, R. (PDF) (报告). World Health Organization (WHO). 2004 [2013-10-14]. (原始内容 (PDF)存档于2012-10-19).
- Murphy, C. D.; Schaffrath, C.; O'Hagan, D. . Chemosphere. 2003, 52 (2): 455–461. Bibcode:2003Chmsp..52..455M. PMID 12738270. doi:10.1016/S0045-6535(03)00191-7.
- O'Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T. G.; Murphy, C. D. . Nature. 2002, 416 (6878): 279. Bibcode:2002Natur.416..279O. PMID 11907567. S2CID 4415511. doi:10.1038/416279a
 .
. - National Oceanic and Atmospheric Administration.
- The National Institute for Occupational Safety and Health. . Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). 1994 [2014-01-15]. (原始内容存档于2022-12-08).
- The National Institute for Occupational Safety and Health. . Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). 1994 [2014-07-13]. (原始内容存档于2023-02-05).
- Keplinger, M. L.; Suissa, L. W. . American Industrial Hygiene Association Journal. 1968, 29 (1): 10–18. PMID 5667185. doi:10.1080/00028896809342975.
- . www.cdc.gov. [2015-11-03]. (原始内容存档于2015-11-17).
- Emsley 2011,第179頁.
- Biller, José. illustrated. Philadelphia: Lippincott Williams & Wilkins. 2007: 939 [2023-02-19]. ISBN 978-0-7817-7906-7. (原始内容存档于2023-07-22).
- Eaton, Charles. . E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). 1997 [2013-09-28].
- Blodgett, D. W.; Suruda, A. J.; Crouch, B. I. (PDF). American Journal of Industrial Medicine. 2001, 40 (2): 215–220. PMID 11494350. doi:10.1002/ajim.1090. (原始内容 (PDF)存档于2012-07-17).
- Hoffman, Robert; Nelson, Lewis; Howland, Mary; Lewin, Neal; Flomenbaum, Neal; Goldfrank, Lewis. . New York: McGraw-Hill Professional. 2007: 1333. ISBN 978-0-07-144310-4.
- Honeywell. (PDF). Morristown: Honeywell International. 2006 [2014-01-09]. (原始内容 (PDF)存档于2013-10-08).
- Fischman, Michael L. . Sullivan, John B.; Krieger, Gary R. (编). 2nd. Philadelphia: Lippincott Williams & Wilkins. 2001: 458–459. ISBN 978-0-683-08027-8.
- El Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. L.; Rumack, B. H. . Veterinary and Human Toxicology. 1989, 31 (3): 243–247. PMID 2741315.
- Roblin, I.; Urban, M.; Flicoteau, D.; Martin, C.; Pradeau, D. . Journal of Burn Care & Research. 2006, 27 (6): 889–894. PMID 17091088. S2CID 3691306. doi:10.1097/01.BCR.0000245767.54278.09.
- Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. . Clinical Toxicology. 2004, 42 (4): 355–361. PMID 15461243. S2CID 27090208. doi:10.1081/CLT-120039541.
- Zorich, Robert. . San Diego: Academic Press. 1991: 182-183. ISBN 978-0-323-14055-3.
- Liteplo, R.; Gomes, R.; Howe, P.; Malcolm, H. . Geneva: United Nations Environment Programme; International Labour Organization; World Health Organization. 2002: 100 [2013-10-14]. ISBN 92-4-157227-2. (原始内容存档于2020-01-12).
- Shin, Richard D.; Silverberg, Mark A. . Medscape. 2013 [2013-10-15]. (原始内容存档于2020-08-06).
- Reddy, D. . Neurology India. 2009, 57 (1): 7–12 [2023-02-23]. PMID 19305069. doi:10.4103/0028-3886.48793. (原始内容存档于2021-11-05).
- Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. . Revista Panamericana de Salud Pública. 2000, 7 (4): 242–248. PMID 10846927. doi:10.1590/S1020-49892000000400005
 .
. - Augenstein, W. L.; et al. . Pediatrics. 1991, 88 (5): 907–912 [2023-02-19]. PMID 1945630. S2CID 22106466. doi:10.1542/peds.88.5.907. (原始内容存档于2010-10-02).
- Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. . New England Journal of Medicine. 1994, 330 (2): 95–99. PMID 8259189. doi:10.1056/NEJM199401133300203
 .
. - Centers for Disease for Control and Prevention. . 2013-07-10 [2013-10-25]. (原始内容存档于2017-07-05).
- Shulman, J. D.; Wells, L. M. . Journal of Public Health Dentistry. 1997, 57 (3): 150–158. PMID 9383753. doi:10.1111/j.1752-7325.1997.tb02966.x.
- Beck, Jefferson; Newman, Paul; Schindler, Trent L.; Perkins, Lori. . National Aeronautics and Space Administration. 2011 [2013-10-15].
- Aucamp, Pieter J.; Björn, Lars Olof. (PDF). United Nations Environmental Programme. 2010 [2013-10-14]. (原始内容 (PDF)存档于2013-09-03).
- Mitchell Crow, James. . Nature. 2011. doi:10.1038/news.2011.293.
- Barry, Patrick L.; Phillips, Tony. . National Aeronautics and Space Administration. 2006-05-26 [2012-01-06]. (原始内容存档于2010-05-27).
- United States Environmental Protection Agency. . 2013a [2013-10-15]. (原始内容存档于2010-12-10).
- United States Environmental Protection Agency. . 2013b [2013-10-15]. (原始内容存档于2015-09-24).
- McCoy, M. . Chemical & Engineering News. 2007, 85 (23): 11. doi:10.1021/cen-v085n023.p011a.
- Forster, P.; Ramaswamy, V.; Artaxo, P.; Berntsen, T.; Betts, R.; Fahey, D. W.; Haywood, J.; Lean, J.; Lowe, D. C.; Myhr e, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. . Solomon, S.; Manning, M.; Chen, Z.; Marquis, M.; Averyt, K. B.; Tignor, M.; Miller, H. L. (编). . Cambridge: Cambridge University. 2007: 212–213. ISBN 978-0-521-70596-7.
- Schwarcz, Joseph A.
 . Toronto: ECW Press. 2004. ISBN 1-55022-621-5.
. Toronto: ECW Press. 2004. ISBN 1-55022-621-5. - Giesy, J. P.; Kannan, K. . Environmental Science & Technology. 2002, 36 (7): 146A–152A. Bibcode:2002EnST...36..146G. PMID 11999053. doi:10.1021/es022253t
 .
. - Steenland, K.; Fletcher, T.; Savitz, D. A. . Environmental Health Perspectives. 2010, 118 (8): 1100–1108. PMC 2920088
 . PMID 20423814. doi:10.1289/ehp.0901827.
. PMID 20423814. doi:10.1289/ehp.0901827. - Betts, K. S. . Environmental Health Perspectives. 2007, 115 (5): A250–A256. PMC 1867999
 . PMID 17520044. doi:10.1289/ehp.115-a250.
. PMID 17520044. doi:10.1289/ehp.115-a250. - United States Environmental Protection Agency. (PDF). 2012 [2013-11-04]. (原始内容 (PDF)存档于2013-10-29).
- Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. . Chemosphere. 2013, 91 (6): 725–32. Bibcode:2013Chmsp..91..725Z. PMID 23498059. doi:10.1016/j.chemosphere.2013.02.024.
- Lau, C.; Anitole, K.; Hodes, C.; Lai, D.; Pfahles-Hutchens, A.; Seed, J. . Toxicological Sciences. 2007, 99 (2): 366–394. PMID 17519394. doi:10.1093/toxsci/kfm128
 .
.
参考书目
- Agricola, Georgius; Hoover, Herbert Clark; Hoover, Lou Henry. . London: The Mining Magazine. 1912.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R. E.; Cue, J. P. . Weinheim: Wiley-VCH: 397–441. 2000. ISBN 3527306730. doi:10.1002/14356007.
- Carlson, D. P.; Schmiegel, W., : 495–533, 2000, ISBN 3527306730, doi:10.1002/14356007.a11_393
- Dean, John A. 15th. New York: McGraw-Hill. 1999. ISBN 0-07-016190-9.
- Emeléus, H. J.; Sharpe, A. G. 27. Academic Press. 1983. ISBN 0-12-023627-3.
- Emsley, John. 2nd. Oxford: Oxford University Press. 2011. ISBN 978-0-19-960563-7.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford: Butterworth Heinemann. 1998. ISBN 0-7506-3365-4.
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. . Weinheim: Wiley-VCH: 381–395. 2000. ISBN 3527306730. doi:10.1002/14356007.a11_293.
- Kirsch, Peer. . Weinheim: Wiley-VCH. 2004. ISBN 978-3-527-30691-6.
- Lewars, Errol G. . Dordrecht: Springer. 2008 [2023-11-19]. ISBN 978-1-4020-6972-7. (原始内容存档于2023-07-22).
- Lide, David R.
 84th. Boca Raton: CRC Press. 2004. ISBN 0-8493-0566-7.
84th. Boca Raton: CRC Press. 2004. ISBN 0-8493-0566-7. - Lidin, R.; Molochko, V. A.; Andreeva, L. L. [Chemical Properties of Inorganic Substances]. Moscow: Khimiya. 2000. ISBN 5-7245-1163-0 (俄语).
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. 6th. Cheltenham: Nelson Thornes. 2002. ISBN 0-7487-6420-8.
- Patnaik, Pradyot. 3rd. Hoboken: John Wiley & Sons. 2007. ISBN 978-0-471-71458-3.
- Siegemund, Günter; Schwertfeger, Werner; Feiring, Andrew; Smart, Bruce; Behr, Fred; Vogel, Herward; McKusick, Blaine, , Wiley, 2000-06-15, ISBN 978-3-527-30385-4, doi:10.1002/14356007.a11_349
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick. . San Diego: Academic Press. 2001. ISBN 978-0-12-352651-9.
外部連結
- 元素氟在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— 氟(英文)
- 元素氟在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素氟在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 氟(英文)






.svg.png.webp)