六氟化物
六氟化物是一类化合物,其化学式为 XnF6m-形式。

已发现的六氟化物
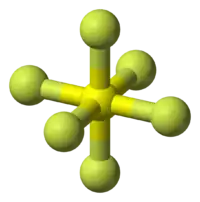
十七种元素形成电中性的六氟化物。其中,九个是过渡金属,三个是锕系元素,四个是 氧族元素,还有一个是惰性气体。 大部分六氟化物是分子型 化合物,有着低熔点 和低 沸点。四种六氟化物 (S、Se、Te和 W) 在室温下 (25 °C) 和 1 atm下是气体, 两种是液体 (Re、Mo),剩下的都是挥发性固体。 6族元素,氧族元素和 惰性气体 形成的六氟化物是无色的,不过其它六氟化物的颜色从白到黄,再到橙、红、棕,到灰色和黑色都有。
过渡金属的六氟化物
| 化合物 | 化学式 | 熔点 (°C) | 沸点 (°C) | 升华点 (°C) | 分子量 | 固态ρ (g cm−3) | 键长(pm) | 颜色 |
|---|---|---|---|---|---|---|---|---|
| 六氟化钼 | MoF 6 | 17.5 | 34.0 | 209.94 | 3.50 (−140 °C)[1] | 181.7[1] | 无色 | |
| 六氟化锝 | TcF 6 | 37.4 | 55.3 | (212) | 3.58 (−140 °C)[1] | 181.2[1] | 黄 | |
| 六氟化钌 | RuF 6 | 54 | 215.07 | 3.68 (−140 °C)[1] | 181.8[1] | 黑棕 | ||
| 六氟化铑 | RhF 6 | ≈ 70 | 216.91 | 3.71 (−140 °C)[1] | 182.4[1] | 黑色 | ||
| 六氟化钨 | WF 6 | 2.3 | 17.1 | 297.85 | 4.86 (−140 °C)[1] | 182.6[1] | 无色 | |
| 六氟化铼 | ReF 6 | 18.5 | 33.7 | 300.20 | 4.94 (−140 °C)[1] | 182.3[1] | 黄 | |
| 六氟化锇 | OsF 6 | 33.4 | 47.5 | 304.22 | 5.09 (−140 °C)[1] | 182.9[1] | 黄 | |
| 六氟化铱 | IrF 6 | 44 | 53.6 | 306.21 | 5.11 (−140 °C)[1] | 183.4[1] | 黄 | |
| 六氟化铂 | PtF 6 | 61.3 | 69.1 | 309.07 | 5.21 (−140 °C)[1] | 184.8[1] | 深红 |
氧族元素的六氟化物
| 化合物 | 化学式 | 熔点 (°C) | 沸点 (°C) | 升华点 (°C) | 分子量 | 固态ρ (g cm−3)(在熔点测量)[2] | 键长 (pm) | 颜色 |
|---|---|---|---|---|---|---|---|---|
| 六氟化硫 | SF 6 | −50.8 | 146.06 | 2.51 (−50 °C) | 156.4 | 无色 | ||
| 六氟化硒 | SeF 6 | −46.6 | 192.95 | 3.27 | 167-170 | 无色 | ||
| 六氟化碲 [3] | TeF 6 | −38.9 | −37.6 | 241.59 | 3.76 | 184 | 无色 | |
| 六氟化钋 [4][5] | PoF 6 | ≈ −40? | 322.99 | 无色[5] |
锕系元素的六氟化物
| 化合物 | 化学式 | 熔点 (°C) | 沸点 (°C) | 升华点 (°C) | 分子量 | 固态ρ (g cm−3) | 键长(pm) | 颜色 |
|---|---|---|---|---|---|---|---|---|
| 六氟化铀 | UF 6 | 69.2 | 56.5 | 352.0193292 | 5.09 | 199.6 | 灰 | |
| 六氟化镎 | NpF 6 | 54.4 | 55.18 | (351) | 198.1 | 橙 | ||
| 六氟化钚 | PuF 6 | 52 | 62 | (358) | 5.08 | 197.1 | 褐 |
六氟化物阴离子

很多元素形成六氟化物阴离子。 其中包括著名的六氟磷酸盐 (PF6−) 和六氟硅酸盐 (SiF62−)。
很多过渡金属也行成六氟化物阴离子。 一级六氟化物阴离子(MF6-)一般由对应的六氟化物被还原而成。 举个例子,PtF6− 可以由 O2还原 PtF6 而成。 由于氟离子的强碱性和对氧化的抗拒性,氟离子配体可以稳定一些金属难见的高氧化态,如: 六氟合铜(IV)酸铯, CuF2−
6 和六氟合镍(IV)酸盐, NiF2−
6。
六氟化物阳离子
六氟化物阳离子存在,但数量少于阴离子和电中性化合物。 六氟化物阳离子的例子包括六氟合氯(VII)𬭩离子 (ClF6+)和六氟合溴(VII)𬭩离子 (BrF6+)。[8]
假想的六氟化物
六氟化氪(KrF
6)被预测是稳定的,但仍未合成,因为將Kr(II)氧化非常難。[9]1990年,科學家試圖將四氟化镅(AmF
4)氟化以制备六氟化镅 (AmF
6) ,[10]但未能成功。科學家也可能对它和六氟化锔(CmF6)进行热色谱鉴定,但是否有结论尚有争议。[11] 六氟化钯(PdF
6)是六氟化铂的较轻同系物,據计算是稳定的,[12]但仍未合成。六氟化银(AgF6)和六氟化金(AuF6)存在的可能性也有讨论。[11]
六氟化铬并不存在,过去被认为是六氟化铬的物质实际上是五氟化铬[13]。
六氟化氡(RnF
6)可以視作六氟化氙的较重版本,理论上存在,但仍未合成。[14]在实验中可能观察到氡的更高价氟化物,其中未知的含氡产物与六氟化氙一起被蒸馏時,在三氧化氡的生产中可能存在RnF4、RnF6,或两者。[15]鉴定氡较高价的氟化物的困难可能是由于氡在动力学上被阻止氧化到超过+2态所致。这导致了RnF2的强离子性和RnF+中Rn上的高正电荷。RnF2分子的分离可能对于清楚地识别氡的较高价氟化物是必要的,其中RnF4预计会比RnF6稳定。这是由于自旋-轨道作用分裂了氡的6p电子壳层导致的 (RnIV将会有6s2
6p2
1/2的闭壳结构)。[16]
参考文献
- Drews, T; Supeł, J; Hagenbach, A; Seppelt, K. . Inorganic Chemistry. May 2006, 45 (9): 3782–3788. PMID 16634614. doi:10.1021/ic052029f.
- Wilhelm Klemm and Paul Henkel "Über einige physikalische Eigenschaften von SF6, SeF6, TeF6 und CF4" Z. anorg. allgem. Chem. 1932, vol. 207, pages 73–86. doi:10.1002/zaac.19322070107
- . 90. Boca Raton, FL: CRC Press. 2009: 4–95. ISBN 978-1-4200-9084-0.
- CAS #35473-38-2
- Holleman, Arnold Frederik; Wiberg, Egon, Wiberg, Nils , 编, , 由Eagleson, Mary; Brewer, William翻译, San Diego/Berlin: Academic Press/De Gruyter: 594, 2001, ISBN 0-12-352651-5
- Bartlett, N. . Angewandte Chemie International Edition. 1968, 7 (6): 433–439. doi:10.1002/anie.196804331.
- . [2020-11-15]. (原始内容存档于2009-09-14).
- Wiberg, Wiberg & Holleman 2001,第436頁.
- Dixon, D. A.; Wang, T. H.; Grant, D. J.; Peterson, K. A.; Christe, K. O.; Schrobilgen, G. J. . Inorganic Chemistry. 2007, 46 (23): 10016–10021. PMID 17941630. doi:10.1021/ic701313h.
- Malm, J. G.; Weinstock, B.; Weaver, E. E. . The Journal of Physical Chemistry. 1958, 62 (12): 1506–1508. doi:10.1021/j150570a009.
- Seppelt, Konrad. . Chemical Reviews. 2015, 115 (2): 1296–1306. doi:10.1021/cr5001783.
- Aullón, G.; Alvarez, S. . Inorganic Chemistry. 2007, 46 (7): 2700–2703. PMID 17326630. doi:10.1021/ic0623819.
- Riedel, Sebastian; Kaupp, Martin. (PDF). Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624 [2012-07-24]. doi:10.1016/j.ccr.2008.07.014. (原始内容 (PDF)存档于2013-06-04).
- Filatov, M.; Cremer, D. . Physical Chemistry Chemical Physics. 2003, 2003 (5): 1103–1105. Bibcode:2003PCCP....5.1103F. doi:10.1039/b212460m.
- Stein, L. . Science. 1970, 168 (3929): 362–4. Bibcode:1970Sci...168..362S. PMID 17809133. doi:10.1126/science.168.3929.362.
- Liebman, Joel F. . Inorg. Nucl. Chem. Lett. 1975, 11 (10): 683–685. doi:10.1016/0020-1650(75)80185-1.