刺猬信号通路
刺猬信号通路(英语:Hedgehog signaling pathway)是一个可将信息传递给胚胎细胞,使其正常分化的信号通路。胚胎的不同部位具有不同浓度的刺猬信号蛋白。该通路不仅作用于胚胎,对成人也有作用。
| 刺猬蛋白 | |
|---|---|
| 标识 | |
| 生物 | |
| 符号 | hh |
| UniProt | Q02936 |
| 其他数据 | |
| 刺猬N端信号 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 鑑定 | |||||||||
| 標誌 | HH_signal | ||||||||
| Pfam | PF01085(旧版) | ||||||||
| InterPro | IPR000320 | ||||||||
| CATH | 3d1m | ||||||||
| SCOP | 3d1m / SUPFAM | ||||||||
| |||||||||
| See also IPR001657. | |||||||||
刺猬因子是动物发育的关键调节因子之一,存在于所有两侧对称动物中。[1]刺猬信号通路的名称来源于其多肽配体,一种在果蝇中发现并称为刺猬(Hh)的细胞内信号分子。刺猬因子是果蝇体节极性基因产物之一,参与建立果蝇形体构型的基础。没有刺猬基因的幼虫会长得短而多刺,样子看起来类似于刺猬,因此得名“刺猬”。刺猬信号通路在胚胎发生和变态的后期阶段仍然很重要。
哺乳动物有三种刺猬同系物,即沙漠刺猬因子(DHH)、印度刺猬因子(IHH)和音猬因子(SHH),其中音猬因子研究得最充分。刺猬信号通路在脊椎动物得胚胎发育过程中同样重要,因此该通路在演化发育生物学中备受关注。在缺乏通路组件的基因剔除老鼠中,它的大脑、骨骼、肌肉组织、胃肠道和肺部都无法正常发育。有研究指出了刺猬信号在调节参与成体组织维持和再生的成体干细胞中发挥作用。
与刺猬信号通路功能障碍相关的疾病包括癌症。[2][3]刺猬信号通路与某些癌症的发展有关,如基底细胞癌。[2]因此许多制药公司正在积极开发专门针对刺猬信号的药物来对抗癌症。
发现

1970年代,发育生物学的一个基本问题是了解一个相对简单的鸡蛋是如何产生复杂的分割形体构型。1970年代后期,克里斯汀·纽斯林-沃尔哈德(Christiane Nüsslein-Volhard)和艾瑞克·威斯乔斯(Eric Wieschaus)分离出了控制果蝇分割前后体轴发育的突变基因。[4]饱和突变技术让他们发现了一组参与身体分割发育的基因,这帮助他们建立了进化发育生物学领域。[5]1995年,他们与爱德华·巴茨·路易斯(Edward B. Lewis)因研究果蝇胚胎发生中的基因突变而共同获得诺贝尔奖。[6]
果蝇刺猬(hh)基因于1992年由Jym Mohler、Philip Beachy、Thomas B. Kornberg和Saigo Kaoru的实验室独立克隆出来。它被确定为对创造身体前后部分的差异很重要的几个基因之一。[7]
一些刺猬突变体会导致胚胎的形状异常,与野生型胚胎相比,它们显得异常粗短。已经根据刺猬体节性基因对幼虫角质层细齿的正常极化分布的影响以及成虫得腿和触角等附属物的特征进了行研究以了解其功能。[8]不同于正常的细齿模式,刺猬突变体幼虫具有密集的细齿。(图1)
粗短和毛茸茸的幼虫的出现启发了“刺猬”这个名字。
果蝇
机制
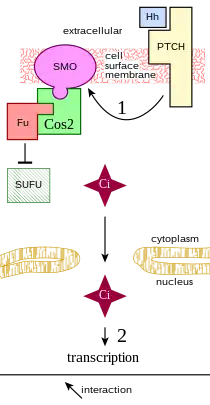
昆虫细胞表达Ci蛋白(Cubitus interruptus),一种全尺寸的锌指转录因子。Ci蛋白与驱动蛋白样蛋白Costal-2(Cos2)形成复合物,并定位于与细胞微管结合的细胞质中(图2)。SCF复合物靶向全长的Ci蛋白(155kDa)进行蛋白酶体依赖性裂解,从而产生一个75kDa的片段,即CiR。CiR在细胞中积累并扩散到细胞核中。在那里它将作为刺猬靶基因的共阻遏物发挥作用。[9]
Ci蛋白通过几种蛋白激酶,如PKA、糖原合成酶激酶-3和酪蛋白激酶1等的磷酸化作用而水解(图2)。[10]果蝇Slimb蛋白是SCF复合物的一部分。Slimb靶向蛋白质进行泛素化并和磷酸化后的Ci蛋白结合。
在没有刺猬信号蛋白的情况下(图3),一种称为PTCH(Patched)的细胞表面跨膜蛋白会阻止称为SMO(Smoothened)的G蛋白偶联受体[11]的高表达和活性。PTCH与已知的膜转运蛋白具有序列相似性。当刺猬信号蛋白存在于细胞质外时,刺猬信号蛋白会与PTCH结合并抑制其活性,从而使SMO积累并抑制Ci蛋白的水解。这个过程很可能会涉及SMO和Costal-2的直接相互作用,并且可能将含有Ci蛋白的复合物封存到一个微域中,导致Ci蛋白水解过程被破坏。[9]目前尚不清楚刺猬信号蛋白与PTCH的结合为什么会导致SMO的水平升高(图3中的相互作用1)。在刺猬信号蛋白与PTCH结合后,SMO的水平大大高于PTCH未与刺猬信号蛋白结合时SMO在细胞中保持的水平。[12]有人认为,有可能SMO的磷酸化在SMO水平的刺猬依赖性调节中起作用。[13]
在具有刺猬信号蛋白激活的PTCH的细胞中,完整的Ci蛋白会在细胞质中积累,并且CiR水平会降低,从而允许某些基因的转录,例如Decapentaplegic(Dpp,骨塑型蛋白生长因子家族的成员)。对于其他刺猬蛋白调节基因,表达不仅需要CiR的缺失,还需要未切割的Ci蛋白作为转录激活因子来积极的调控。[10]Costal-2通常是将Ci蛋白保留在细胞质中的关键蛋白,但SMO与Costal-2的相互作用会允许一些完整的Ci蛋白进入细胞核。
果蝇Fu蛋白(Fused)是一种与Costal-2结合的蛋白激酶。Fu可以抑制SUFU(Fu抑制因子),后者又与Ci蛋白相互作用以调节某些细胞类型中的基因转录。[14]
作用

刺猬信号通路在幼虫体节发育和成虫附肢形成中发挥作用。在发育中的果蝇胚胎的体节形成期间,合成转录因子Engrailed基因的细胞条带也可以表达细胞间的刺猬信号蛋白(图4中的绿色)。刺猬信号蛋白不能自由地远离制造它的细胞,因此它只会激活与表达engrailed的细胞相邻的一条细条的细胞。当以这种局部方式发挥作用时,刺猬信号蛋白会以旁分泌因子的形式发挥作用。在刺猬蛋白与受体蛋白PTCH产生相互作用后,只有位于表达engrailed的细胞的一侧的细胞才能对刺猬信号蛋白做出反应(图4中的蓝色)。
具有刺猬激活的PTCH受体的细胞合成Wingless蛋白(图4中的红色)。如果改变果蝇胚胎,使其在所有细胞中产生刺猬蛋白,所有感受态细胞都会做出反应,并在每个区段中形成更宽的Wingless表达细胞带。Wingless基因有一个上游转录调节区,以刺猬依赖性的方式与Ci转录因子结合,导致邻近刺猬蛋白产生细胞条带的细胞中的Wingless转录增加(图3中的相互作用2)。[15]
Wingless蛋白作为一种细胞外信号,通过激活其细胞表面的卷曲受体来排列相邻的细胞行。Wingless蛋白作用于表达engrailed的细胞以稳定engrailed表达的条带。Wingless蛋白是细胞间信号蛋白Wnt家族的成员。刺猬蛋白和Wingless蛋白的相互信号传递稳定了副体节之间的边界(图4顶部)。Wingless蛋白和刺猬信号蛋白对每个节段中其他细胞条带的影响建立了一个位置代码,该代码说明了节段前后轴上不同的解剖特征。[16]
Wingless蛋白之所以被称为“Wingless”,是因为一些无翼果蝇突变体的表型。Wingless蛋白和刺猬蛋白在变态过程中共同发挥作用,协调翅膀的形成。刺猬蛋白在发育中的果蝇四肢的后部表达。刺猬蛋白还参与眼睛、大脑、性腺、肠道和气管发育的协调。刺猬蛋白的下调被认为与片脚类动物钩虾的眼睛发育减少有关。[17]
环节动物门
刺猬信号通路也参与环节动物的分节,因为平行进化似乎不太可能,这表明两个门之间的分节有共同的起源。[18]虽然刺猬因子不会诱导分节的形成,但它似乎在分节出现后起到稳定分节区域的作用。[18]
脊椎动物
机制
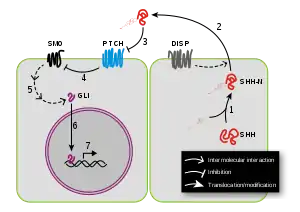
音猬因子(SHH)是脊椎动物通路中研究最充分的配体。大多数关于刺猬信号的已知信息都是通过研究SHH建立的。它被翻译为~45kDa前体并经历自催化处理(图5中的过程1),产生~20kDa N端信号结构域(称为SHH-N)和一个~25kDa C端结构域,没有已知的信号作用。在裂解过程中,胆固醇分子被添加到N端结构域的羧基端,[19]参与配体的运输、分泌和受体相互作用。SHH能以自分泌的方式发出信号,并影响产生它的细胞。分泌和随之而来的旁分泌刺猬信号需要DISP(Dispatched)蛋白的参与(图5中的过程2)。
当SHH到达其靶细胞时,它会与PTCH1(Patched-1)受体结合(图5中的过程3,蓝色分子)。在没有配体的情况下,PTCH1会抑制SMO,这是该通路中的下游蛋白(图5中的过程4)。有人认为SMO是由一种小分子调节的,其细胞定位则由PTCH控制。[20]PTCH1与尼曼匹克症C1型(NPC1)具有同源性,已知后者可以跨膜运输亲脂性分子。[21]PTCH1有一个甾醇感应结构域(SSD),已被证明对抑制SMO的活性至关重要。[22]目前的一个理论认为,PTCH通过从SMO中去除氧化胆固醇来调节SMO。PTCH的作用类似于胆固醇泵,可去除由7-脱氢胆固醇还原酶产生的氧化胆固醇。[23]当刺猬蛋白结合或PTCH的SSD发生突变时,泵被关闭,并允许氧化胆固醇积聚在SMO周围。

这种胆固醇的积累使SMO变得活跃或在膜上停留更长的时间。这一假设得到了作用于SMO的通路的许多小分子激动剂和拮抗剂的支持。SHH的结合解除了SMO的抑制,导致GLI转录因子的激活(图6中的过程5):激活因子Gli1和Gli2以及抑制因子Gli3。将SMO连接到GLI的分子事件的序列知之甚少。被激活的GLI在细胞核中积累(图6中的过程6)并控制刺猬靶基因的转录(图6中的过程7)。最近有报告称PTCH1通过独立于SMO受体的机制抑制刺猬靶基因的转录。[24]
除了PTCH1,哺乳动物还有另一个刺猬受体,PTCH2,其序列对比与PTCH1的一致性为54%。[25]那三种哺乳动物刺猬因子都以相似的亲和性结合这两种受体,因此PTCH1和PTCH2不能区分配体。然而,它们的表达模式确实不同。PTCH2在睾丸中的表达水平更高,并在那里调节沙漠刺猬信号。[25]PTCH2似乎有一个与PTCH1不同的下游信号作用。在没有配体结合的情况下,PTCH2抑制SMO活性的能力下降。[26]此外,在基底细胞癌中,PTCH2的过度表达并不能取代突变的PTCH1。[27]
在无脊椎动物中,就像在果蝇中一样,刺猬信号蛋白与PTCH的结合会导致配体的内化和封存。[28]因此,刺猬信号蛋白在体内通过表达受体的感受野会导致信号衰减,这种效应称为配体依赖性拮抗(LDA)。与果蝇相反,脊椎动物通过刺猬相互作用蛋白1(HHIP1)介导的LDA具有另一种水平的刺猬调节。HHIP1也能封存刺猬配体,但与PTCH不同,它对SMO的活性没有影响。[29]
作用

刺猬家族的成员在各种发育过程中发挥着关键作用。[16]研究得最充分的例子之一是音猬因子在脊椎动物肢体发育过程中的作用。1968年,[30]Saunders和Gasseling对小鸡肢芽的发育所做的经典实验[31]形成了形态发生素概念的基础。他们表明,小鸡肢体中的Digit的特性是由极化活动区(ZPA)产生的被动运输因子决定的,ZPA是位于肢体后缘的一个小区域的组织。哺乳动物的发育似乎遵循同样的模式。这种被动运输的因子后来被证明是音猬因子。然而,直到现在,音猬因子究竟如何确定Digit的特性仍然是个谜。目前由Harfe等人提出的模型指出,[32]接触音猬因子的浓度和时间都决定了小鼠胚胎组织的发育走向。(图6)
Digit V、IV和部分的III是直接来自在胚胎发生过程中表达音猬因子的细胞。在这些细胞中,音猬因子以自分泌的方式发出信号,这些Digit在没有DISP的情况下正常发育,而DISP是配体的细胞外扩散所必需的。这些Digit在音猬因子持续表达的时间长度上有所不同。最靠后的是Digit V,由表达配体时间最长的细胞发育而来。而Digit IV细胞表达音猬因子的时间较短,Digit III细胞表达时间则更短。Digit II由暴露在中等浓度的细胞外音猬因子中的细胞发展而来。Digit I的发育不需要音猬因子。从某种意义上说,它是肢芽细胞的默认程序。
刺猬信号在成人中仍然很重要。音猬因子已被证明可以促进来自各种组织的成体干细胞的增殖,包括原始造血细胞、[33]乳腺[34]和神经干细胞。[35]毛囊从静止期过渡到生长期需要刺猬信号通路的激活。[36]由于在动物模型中发现的毒性,这一点失败了。[37]
人类的相关疾病
在胚胎发育过程中,通过有害突变或妊娠的母亲服用致畸剂等,刺猬信号的中断可导致严重的发育异常。全前脑畸形是指胚胎前脑不能分裂形成大脑半球,发生概率约为每8,000名活产婴儿中有1人患有,每200名自然流产婴儿中有1人患有,通常与参与刺猬通路的基因突变有关,包括音猬因子和PTCH。[38]如果妊娠期的哺乳动物食用了通路抑制剂环杷明,就会导致全前脑畸形中最严重的缺陷之一,独眼畸形。[39]
刺猬信号通路的激活与各种器官的癌症发展有关联,包括脑、肺、乳腺、前列腺和皮肤。基底细胞癌是最常见的癌症恶性肿瘤,与刺猬信号通路的关系最为密切。在患有这种疾病的患者中发现PTCH的功能丧失性突变和SMO的激活性突变。[40]刺猬信号通路的异常激活可能通过将成体干细胞转化为癌症干细胞而导致疾病的发展,从而产生肿瘤。癌症研究人员希望,刺猬信号的特异性抑制剂能够为各种恶性肿瘤提供有效的治疗。[41]刺猬信号通路和癌症发展之间的联系是非常复杂的。然而,很明显刺猬信号的异常激活会导致肿瘤细胞的生长、增殖和侵袭。[42]除了参与癌症的发展外,刺猬信号通路还可能导致主要的呼吸系统疾病,如肺纤维化,[43]和慢性阻塞性肺病等。[44][45][46]
靶向刺猬信号通路
靶向此通路的最常见方法是调节SMO。SMO的拮抗剂和激动剂已被证明会影响下游的通路调节。目前有几种刺猬信号通路抑制剂可用于癌症治疗,如维斯莫吉布(vismodegib)和索尼吉布(sonidegib)。这些药物被认为是有前途的癌症治疗药物,特别是对于难治性或晚期癌症患者。SMO抑制剂代表了对某些类型癌症的潜在治疗方法。然而,由于SMO抑制剂的有害和潜在的毒副作用,在儿童中的安全性尚未确定,以及有证据表明一些病人对SMO抑制剂产生抗性,因此需要新的药物类别。[42]临床上最先进的SMO靶向剂是竞争性环杷明。伊曲康唑(药品名为斯皮仁诺)也被证明可以通过不同于环巴胺和维斯莫吉布的机制靶向SMO。[47]伊曲康唑在赋予维斯莫吉布和其他竞争性环杷明拮抗剂(如沙利吉布和索尼吉布[48])抗性的突变存在时抑制SMO。PTCH[49]和Gli3(5E1)[50]抗体也是调节刺猬信号通路的一种方式。下游效应器和强转录激活剂SiRNA Gli1已被用于抑制细胞生长和促进细胞凋亡。[51]砒霜(三氧化二砷)也被证明可以通过干扰Gli的功能和转录来抑制刺猬信号。[52][53]
刺猬信号传导的几个环境修饰物已被确认,它们是潜在的健康或发育危害。在番茄(番茄碱)、[54]马铃薯(茄啶)、[54]茄属植物如辣椒和茄子(茄解定)[54]及姜黄(姜黄素)[55]中发现的膳食生物碱已被证明可以对抗SMO并扰乱刺猬信号。此外,某些环境毒物可以阻断刺猬信号传导。胡椒基丁醚(PBO)是1940年代开发的一种半合成农药添加剂,可以在上千户家庭和农产品中找到。[56]尽管PBO被广泛使用,但直到最近才认识到它能够抑制刺猬信号传导并作为一种强有力的发育致畸剂。[57][58]
进化

作为原始脊索动物的文昌鱼,只拥有一个果蝇刺猬的同源物(图7)。另一方面,脊椎动物有几个刺猬配体,它们属于三个亚群,即沙漠刺猬亚群、印度刺猬亚群和音猬亚群,每个亚群由一个哺乳动物基因代表。这是脊椎动物进化史早期发生的两轮全基因组复制的结果。[65]两个这样的事件会产生四个同源基因,可以肯定的是其中一个已经丢失了。沙漠刺猬是与果蝇刺猬关系最密切的。在一些物种中发生了额外的基因重复,[16]例如斑马鱼,它在音猬组中有一个额外的Tiggywinkle刺猬(TwHH)基因。各种脊椎动物谱系使刺猬适应了独特的发育过程。例如,X.laevis带状刺猬的同源物参与了蝾螈肢体的再生。[66]
音猬因子在导致人类的灵长类谱系中经历了加速进化。[67]Dorus等人假设,这允许对蛋白进行更复杂的调节,并可能在人脑体积和复杂性的增加中发挥了作用。
Wnt受体的卷曲家族与SMO有一定的序列相似性。[68]SMO似乎是G蛋白偶联受体超家族中功能最不一样的成员。Wnt和刺猬信号通路之间的其他相似之处也已被发现。[69]Nusse观察到,一个基于脂质修饰蛋白和特定膜转运蛋白的信号系统很古老,Wnt和刺猬信号通路可能是从那儿演化而来。
有人认为,无脊椎动物和脊椎动物在SMO下游的信号传递已经有了很大的分歧。[70]SUFU在脊椎动物中的作用有所增强,而在果蝇中作用相对较小。Costal-2在果蝇中特别重要。蛋白激酶Fu是果蝇SUFU的调节器,但可能在脊椎动物的刺猬信号通路中不起作用。[71]在脊椎动物中,刺猬信号与纤毛的发育密切相关。[72]
刺猬蛋白家族中存在显着的结构域级进化,N端结构域(hedge)和C端结构域(hog),它们后来拼接在一起成为一个转录单元。[73][74]Hog结构域包含一个称为Hint(刺猬INTein)的序列,它在序列和功能上与细菌和真菌内含肽相似。[75]Hog结构域存在于许多真核生物的分支中,即红藻、苔藓、双鞭毛虫、角叉菜和其他单细胞真核生物。[76]领鞭毛虫(Choanoflagellate)含有一个名为hoglet的基因,该基因也编码刺猬C端结构域Hog结构。然而,领鞭毛虫和低等真核生物不包含任何类似于hedge结构域的区域,这表明hoglet首先进化了。[75][76]多孔动物(Porifera)既有hedge样蛋白(称为hedgling),也有hog样蛋白,但它们作为两个完全独立的转录单元存在。[73][74]刺胞动物(Cnidaria)含有hedgling和hog这两种基因,而且它也有完整的hedgehog基因,这说明hedge和hog是在多孔动物和刺胞动物的最后一个共同祖先之后拼接成刺猬(hedgehog)的。[74]
两侧对称动物不包含hedgling基因,这表明在这一分支从其他后生动物中分裂出来之前,这些基因已经丢失了。[1]然而,不含Hedge结构域的含Hog结构域的基因存在于几个两侧对称谱系中,即冠轮动物和线虫动物。[77]刺猬样基因、PTCH2同系物和PTCH相关基因存在于秀丽隐杆线虫(Caenorhabditis elegans)中。[78][79]这些基因已被证明是编码在秀丽隐杆线虫发育中发挥作用的蛋白质。[78][79]虽然刺嘴纲线虫保留了真正的刺猬基因,但色矛纲线虫已经失去了原型刺猬基因,取而代之的是进化出了61个不同的半同源基因,这些基因具有与Hog相关的新N端结构域。[76][77]这些与秀丽隐杆线虫中的Hog有关的N端结构随后被分类,最初是Warthog(WRT)和Groundhog(GRD),然后是Ground-like(GRL)和Quahog(QUA)。[78][79]秀丽隐杆线虫以及其他线虫物种已经失去了GPCR SMO。[78][79]
参见
参考文献
- Ingham PW, Nakano Y, Seger C. . Nature Reviews Genetics. June 2011, 12 (6): 393–406. PMID 21502959. S2CID 33769324. doi:10.1038/nrg2984.
- Jamieson C, Martinelli G, Cortes J. . Blood Cancer Discovery. September 2020, 1 (2): 134–145. PMC 8447269
 . PMID 34661144. doi:10.1158/2643-3230.BCD-20-0007
. PMID 34661144. doi:10.1158/2643-3230.BCD-20-0007  .
. - Kimball's Biology Pages 的存檔,存档日期26 June 2008., The Hedgehog Signaling Pathway
- Nüsslein-Volhard C, Wieschaus E. . Nature. October 1980, 287 (5785): 795–801. Bibcode:1980Natur.287..795N. PMID 6776413. S2CID 4337658. doi:10.1038/287795a0.
- Arthur W. . Nature. February 2002, 415 (6873): 757–64. Bibcode:2002Natur.415..757A. PMID 11845200. S2CID 4432164. doi:10.1038/415757a.
- 1995 Nobel Prize for discovery of the genetic control of early embryonic development (页面存档备份,存于)
- . embryo.asu.edu. [2023-01-10]. (原始内容存档于2023-01-10).
- Mohler J. . Genetics. December 1988, 120 (4): 1061–72. PMC 1203569
 . PMID 3147217. doi:10.1093/genetics/120.4.1061.
. PMID 3147217. doi:10.1093/genetics/120.4.1061. - Collins RT, Cohen SM. . Genetics. May 2005, 170 (1): 173–84. PMC 1449730
 . PMID 15744048. doi:10.1534/genetics.104.039420.
. PMID 15744048. doi:10.1534/genetics.104.039420. - Lum L, Beachy PA. . Science. June 2004, 304 (5678): 1755–9. Bibcode:2004Sci...304.1755L. CiteSeerX 10.1.1.476.3902
 . PMID 15205520. S2CID 13949436. doi:10.1126/science.1098020.
. PMID 15205520. S2CID 13949436. doi:10.1126/science.1098020. - Chen W, Ren XR, Nelson CD, Barak LS, Chen JK, Beachy PA, de Sauvage F, Lefkowitz RJ. . Science. December 2004, 306 (5705): 2257–60. Bibcode:2004Sci...306.2257C. PMID 15618519. S2CID 12823611. doi:10.1126/science.1104135.
- Alcedo J, Zou Y, Noll M. . Molecular Cell. August 2000, 6 (2): 457–65. PMID 10983991. doi:10.1016/S1097-2765(00)00044-7
 .
. - Apionishev S, Katanayeva NM, Marks SA, Kalderon D, Tomlinson A. . Nature Cell Biology. January 2005, 7 (1): 86–92. PMID 15592457. S2CID 5958856. doi:10.1038/ncb1210.
- Ho KS, Suyama K, Fish M, Scott MP. . Development. March 2005, 132 (6): 1401–12. PMID 15750186. doi:10.1242/dev.01689
 .
. - Von Ohlen T, Lessing D, Nusse R, Hooper JE. . Proceedings of the National Academy of Sciences of the United States of America. March 1997, 94 (6): 2404–9. Bibcode:1997PNAS...94.2404V. PMC 20100
 . PMID 9122207. doi:10.1073/pnas.94.6.2404
. PMID 9122207. doi:10.1073/pnas.94.6.2404  .
. - Ingham PW, McMahon AP. . Genes & Development. December 2001, 15 (23): 3059–87. PMID 11731473. doi:10.1101/gad.938601
 .
. - Aspiras AC, Prasad R, Fong DW, Carlini DB, Angelini DR. . Journal of Evolutionary Biology. May 2012, 25 (5): 995–1001. PMID 22462461. S2CID 37541721. doi:10.1111/j.1420-9101.2012.02481.x.
- Dray N, Tessmar-Raible K, Le Gouar M, Vibert L, Christodoulou F, Schipany K, Guillou A, Zantke J, Snyman H, Béhague J, Vervoort M, Arendt D, Balavoine G. . Science. July 2010, 329 (5989): 339–42. Bibcode:2010Sci...329..339D. PMC 3182550
 . PMID 20647470. doi:10.1126/science.1188913.
. PMID 20647470. doi:10.1126/science.1188913. - Banavali NK. . Journal of Computational Chemistry. November 2019, 41 (6): 520–527. PMID 31823413. doi:10.1002/jcc.26097
 .
. - Taipale J, Cooper MK, Maiti T, Beachy PA. . Nature. August 2002, 418 (6900): 892–7. Bibcode:2002Natur.418..892T. PMID 12192414. S2CID 4362029. doi:10.1038/nature00989.
- Davies JP, Chen FW, Ioannou YA. . Science. December 2000, 290 (5500): 2295–8. Bibcode:2000Sci...290.2295D. PMID 11125140. doi:10.1126/science.290.5500.2295.
- Strutt H, Thomas C, Nakano Y, Stark D, Neave B, Taylor AM, Ingham PW. . Current Biology. April 2001, 11 (8): 608–13. PMID 11369206. S2CID 235311937. doi:10.1016/S0960-9822(01)00179-8
 .
. - Corcoran RB, Scott MP. . Proceedings of the National Academy of Sciences of the United States of America. May 2006, 103 (22): 8408–13. Bibcode:2006PNAS..103.8408C. PMC 1462959
 . PMID 16707575. doi:10.1073/pnas.0602852103
. PMID 16707575. doi:10.1073/pnas.0602852103  .
. - Rahnama F, Shimokawa T, Lauth M, Finta C, Kogerman P, Teglund S, Toftgård R, Zaphiropoulos PG. . The Biochemical Journal. February 2006, 394 (Pt 1): 19–26. PMC 1385998
 . PMID 16229683. doi:10.1042/BJ20050941.
. PMID 16229683. doi:10.1042/BJ20050941. - Carpenter D, Stone DM, Brush J, Ryan A, Armanini M, Frantz G, Rosenthal A, de Sauvage FJ. . Proceedings of the National Academy of Sciences of the United States of America. November 1998, 95 (23): 13630–4. Bibcode:1998PNAS...9513630C. PMC 24870
 . PMID 9811851. doi:10.1073/pnas.95.23.13630
. PMID 9811851. doi:10.1073/pnas.95.23.13630  .
. - Rahnama F, Toftgård R, Zaphiropoulos PG. . The Biochemical Journal. March 2004, 378 (Pt 2): 325–34. PMC 1223965
 . PMID 14613484. doi:10.1042/BJ20031200.
. PMID 14613484. doi:10.1042/BJ20031200. - Zaphiropoulos PG, Undén AB, Rahnama F, Hollingsworth RE, Toftgård R. . Cancer Research. February 1999, 59 (4): 787–92. PMID 10029063.
- Incardona JP, Lee JH, Robertson CP, Enga K, Kapur RP, Roelink H. . Proceedings of the National Academy of Sciences of the United States of America. October 2000, 97 (22): 12044–9. Bibcode:2000PNAS...9712044I. PMC 17291
 . PMID 11027307. doi:10.1073/pnas.220251997
. PMID 11027307. doi:10.1073/pnas.220251997  .
. - Jeong J, McMahon AP. . Development. January 2005, 132 (1): 143–54. PMID 15576403. doi:10.1242/dev.01566
 .
. - J.W. Saunders, M.T. Gasseling, Ectodermal-mesenchymal interactions in the origin of limb symmetry R. Fleischmajer, R.E. Billingham (Eds.), Epithelial-Mesenchymal Interactions, Williams & Wilkins, Baltimore (1968), pp. 78-97
- SAUNDERS JW Jr. The proximo-distal sequence of origin of the parts of the chick wing and the role of the ectoderm. J Exp Zool. 1948 Aug;108(3):363-403. doi: 10.1002/jez.1401080304. PMID 18882505.
- Harfe BD, Scherz PJ, Nissim S, Tian H, McMahon AP, Tabin CJ. . Cell. August 2004, 118 (4): 517–28. PMID 15315763. S2CID 16280983. doi:10.1016/j.cell.2004.07.024
 .
. - Bhardwaj G, Murdoch B, Wu D, Baker DP, Williams KP, Chadwick K, Ling LE, Karanu FN, Bhatia M. . Nature Immunology. February 2001, 2 (2): 172–80. PMID 11175816. S2CID 27907370. doi:10.1038/84282.
- Liu S, Dontu G, Mantle ID, Patel S, Ahn NS, Jackson KW, Suri P, Wicha MS. . Cancer Research. June 2006, 66 (12): 6063–71. PMC 4386278
 . PMID 16778178. doi:10.1158/0008-5472.CAN-06-0054.
. PMID 16778178. doi:10.1158/0008-5472.CAN-06-0054. - Ahn S, Joyner AL. . Nature. October 2005, 437 (7060): 894–7. Bibcode:2005Natur.437..894A. PMID 16208373. S2CID 4431022. doi:10.1038/nature03994.
- Paladini RD, Saleh J, Qian C, Xu GX, Rubin LL. . The Journal of Investigative Dermatology. October 2005, 125 (4): 638–46. PMID 16185261. doi:10.1111/j.0022-202X.2005.23867.x
 .
. - http://phx.corporate-ir.net/phoenix.zhtml?c=123198&p=irol-newsArticle&ID=997941&highlight=
- OMIM Holoprosencephaly -236100
- Keeler RF. . Lipids. October 1978, 13 (10): 708–15. PMID 723484. S2CID 1119899. doi:10.1007/BF02533750.
- Xie J, Murone M, Luoh SM, Ryan A, Gu Q, Zhang C, Bonifas JM, Lam CW, Hynes M, Goddard A, Rosenthal A, Epstein EH, de Sauvage FJ. . Nature. January 1998, 391 (6662): 90–2. Bibcode:1998Natur.391...90X. PMID 9422511. S2CID 205003240. doi:10.1038/34201.
- Chen JK, Taipale J, Young KE, Maiti T, Beachy PA. . Proceedings of the National Academy of Sciences of the United States of America. October 2002, 99 (22): 14071–6. Bibcode:2002PNAS...9914071C. PMC 137838
 . PMID 12391318. doi:10.1073/pnas.182542899
. PMID 12391318. doi:10.1073/pnas.182542899  .
. - Skoda AM, Simovic D, Karin V, Kardum V, Vranic S, Serman L. . Bosnian Journal of Basic Medical Sciences. February 2018, 18 (1): 8–20. PMC 5826678
 . PMID 29274272. doi:10.17305/bjbms.2018.2756.
. PMID 29274272. doi:10.17305/bjbms.2018.2756. - Cigna N, Farrokhi Moshai E, Brayer S, Marchal-Somme J, Wémeau-Stervinou L, Fabre A, et al. . The American Journal of Pathology. December 2012, 181 (6): 2126–37. PMID 23031257. doi:10.1016/j.ajpath.2012.08.019
 .
. - Wang C, de Mochel NS, Christenson SA, Cassandras M, Moon R, Brumwell AN, et al. . The Journal of Clinical Investigation. October 2018, 128 (10): 4343–4358. PMC 6159975
 . PMID 29999500. doi:10.1172/JCI99435.
. PMID 29999500. doi:10.1172/JCI99435. - Ancel J, Belgacemi R, Perotin JM, Diabasana Z, Dury S, Dewolf M, et al. . Respiratory Research. August 2020, 21 (1): 207. PMC 7412648
 . PMID 32767976. doi:10.1186/s12931-020-01478-x.
. PMID 32767976. doi:10.1186/s12931-020-01478-x. - Belgacemi R, Luczka E, Ancel J, Diabasana Z, Perotin JM, Germain A, et al. . EBioMedicine. January 2020, 51: 102572. PMC 6931110
 . PMID 31877414. doi:10.1016/j.ebiom.2019.11.033.
. PMID 31877414. doi:10.1016/j.ebiom.2019.11.033. - Kim J, Tang JY, Gong R, Kim J, Lee JJ, Clemons KV, Chong CR, Chang KS, Fereshteh M, Gardner D, Reya T, Liu JO, Epstein EH, Stevens DA, Beachy PA. . Cancer Cell. April 2010, 17 (4): 388–99. PMC 4039177
 . PMID 20385363. doi:10.1016/j.ccr.2010.02.027.
. PMID 20385363. doi:10.1016/j.ccr.2010.02.027. - Kim J, Aftab BT, Tang JY, Kim D, Lee AH, Rezaee M, Kim J, Chen B, King EM, Borodovsky A, Riggins GJ, Epstein EH, Beachy PA, Rudin CM. . Cancer Cell. January 2013, 23 (1): 23–34. PMC 3548977
 . PMID 23291299. doi:10.1016/j.ccr.2012.11.017.
. PMID 23291299. doi:10.1016/j.ccr.2012.11.017. - Nakamura M, Kubo M, Yanai K, Mikami Y, Ikebe M, Nagai S, Yamaguchi K, Tanaka M, Katano M. . Anticancer Research. 2007, 27 (6A): 3743–7. PMID 17970037.
- Hunt R, Bragina O, Drews M, Kasak L, Timmusk S, Valkna A, Kogerman P, Järvekülg L. . Hybridoma. August 2007, 26 (4): 231–40. PMID 17725385. doi:10.1089/hyb.2007.0507.
- Stecca B, Mas C, Ruiz i Altaba A. . Trends in Molecular Medicine. May 2005, 11 (5): 199–203. PMID 15882606. doi:10.1016/j.molmed.2005.03.004.
- Beauchamp EM, Ringer L, Bulut G, Sajwan KP, Hall MD, Lee YC, Peaceman D, Ozdemirli M, Rodriguez O, Macdonald TJ, Albanese C, Toretsky JA, Uren A. . The Journal of Clinical Investigation. January 2011, 121 (1): 148–60. PMC 3007144
 . PMID 21183792. doi:10.1172/JCI42874.
. PMID 21183792. doi:10.1172/JCI42874. - Kim J, Lee JJ, Kim J, Gardner D, Beachy PA. . Proceedings of the National Academy of Sciences of the United States of America. July 2010, 107 (30): 13432–7. Bibcode:2010PNAS..10713432K. PMC 2922148
 . PMID 20624968. doi:10.1073/pnas.1006822107
. PMID 20624968. doi:10.1073/pnas.1006822107  .
. - Lipinski RJ, Bushman W. . Toxicology in Vitro (Toxicol In Vitro). August 2010, 24 (5): 1404–9. PMC 2891024
 . PMID 20434536. doi:10.1016/j.tiv.2010.04.011.
. PMID 20434536. doi:10.1016/j.tiv.2010.04.011. - Elamin MH, Shinwari Z, Hendrayani SF, Al-Hindi H, Al-Shail E, Khafaga Y, et al. . Molecular Carcinogenesis. March 2010, 49 (3): 302–14. PMID 20025076. S2CID 31459213. doi:10.1002/mc.20604.
- (PDF). USEPA. [2022-12-21]. (原始内容存档 (PDF)于2022-05-31).
- Wang J, Lu J, Mook RA, Zhang M, Zhao S, Barak LS, et al. . Toxicological Sciences. August 2012, 128 (2): 517–23. PMC 3493191
 . PMID 22552772. doi:10.1093/toxsci/kfs165.
. PMID 22552772. doi:10.1093/toxsci/kfs165. - Everson JL, Sun MR, Fink DM, Heyne GW, Melberg CG, Nelson KF, Doroodchi P, Colopy LJ, Ulschmid CM, Martin AA, McLaughlin MT, Lipinski RJ. . Environmental Health Perspectives. October 2019, 127 (10): 107006. PMC 6867268
 . PMID 31642701. doi:10.1289/EHP5260
. PMID 31642701. doi:10.1289/EHP5260  .
. - Li X, Deng W, Nail CD, Bailey SK, Kraus MH, Ruppert JM, Lobo-Ruppert SM. . Oncogene. January 2006, 25 (4): 609–21. PMC 1361531
 . PMID 16158046. doi:10.1038/sj.onc.1209077.
. PMID 16158046. doi:10.1038/sj.onc.1209077. - Lee SW, Moskowitz MA, Sims JR. . International Journal of Molecular Medicine. March 2007, 19 (3): 445–51. PMID 17273793. doi:10.3892/ijmm.19.3.445
 .
. - Adolphe C, Hetherington R, Ellis T, Wainwright B. . Cancer Research. February 2006, 66 (4): 2081–8. PMID 16489008. doi:10.1158/0008-5472.CAN-05-2146
 .
. - Athar M, Li C, Tang X, Chi S, Zhang X, Kim AL, Tyring SK, Kopelovich L, Hebert J, Epstein EH, Bickers DR, Xie J. . Cancer Research. October 2004, 64 (20): 7545–52. PMID 15492281. doi:10.1158/0008-5472.CAN-04-1393
 .
. - Clinical trial number NCT00636610 for "A Study of GDC-0449 (Hedgehog Pathway Inhibitor) With Concurrent Chemotherapy and Bevacizumab As First-Line Therapy for Metastatic Colorectal Cancer" at ClinicalTrials.gov
- Clinical trial number NCT01108094 for "Pilot Biomarker Trial to Evaluate the Efficacy of Itraconazole in Patients w/ Basal Cell Carcinomas" at ClinicalTrials.gov
- Wada H, Makabe K. . International Journal of Biological Sciences. 2006, 2 (3): 133–41. PMC 1474148
 . PMID 16763673. doi:10.7150/ijbs.2.133.
. PMID 16763673. doi:10.7150/ijbs.2.133. - Stark DR, Gates PB, Brockes JP, Ferretti P. . Developmental Dynamics. July 1998, 212 (3): 352–63. PMID 9671939. doi:10.1002/(SICI)1097-0177(199807)212:3<352::AID-AJA3>3.0.CO;2-G
 .
. - Dorus S, Anderson JR, Vallender EJ, Gilbert SL, Zhang L, Chemnick LG, Ryder OA, Li W, Lahn BT. . Human Molecular Genetics. July 2006, 15 (13): 2031–7. PMID 16687440. doi:10.1093/hmg/ddl123
 .
. - Graul RC, Sadée W. . AAPS PharmSci. 2001, 3 (2): 25–42. PMC 2779559
 . PMID 11741263. doi:10.1208/ps030212.
. PMID 11741263. doi:10.1208/ps030212. - Nusse R. . Development. November 2003, 130 (22): 5297–305. PMID 14530294. doi:10.1242/dev.00821
 .
. - Varjosalo M, Li SP, Taipale J. . Developmental Cell. February 2006, 10 (2): 177–86. PMID 16459297. doi:10.1016/j.devcel.2005.12.014
 .
. - Chen MH, Gao N, Kawakami T, Chuang PT. . Molecular and Cellular Biology. August 2005, 25 (16): 7042–53. PMC 1190231
 . PMID 16055716. doi:10.1128/MCB.25.16.7042-7053.2005.
. PMID 16055716. doi:10.1128/MCB.25.16.7042-7053.2005. - Huangfu D, Anderson KV. . Development. January 2006, 133 (1): 3–14. PMID 16339192. doi:10.1242/dev.02169
 .
. - Matus DQ, Magie CR, Pang K, Martindale MQ, Thomsen GH. . Developmental Biology. January 2008, 313 (2): 501–18. PMC 2288667
 . PMID 18068698. doi:10.1016/j.ydbio.2007.09.032.
. PMID 18068698. doi:10.1016/j.ydbio.2007.09.032. - Adamska M, Matus DQ, Adamski M, Green K, Rokhsar DS, Martindale MQ, Degnan BM. . Current Biology. October 2007, 17 (19): R836–7. PMID 17925209. S2CID 15158554. doi:10.1016/j.cub.2007.08.010
 .
. - Snell EA, Brooke NM, Taylor WR, Casane D, Philippe H, Holland PW. . Proceedings. Biological Sciences. February 2006, 273 (1585): 401–7. PMC 1560198
 . PMID 16615205. doi:10.1098/rspb.2005.3263.
. PMID 16615205. doi:10.1098/rspb.2005.3263. - Bürglin TR. . BMC Genomics. March 2008, 9 (127): 127. PMC 2362128
 . PMID 18334026. doi:10.1186/1471-2164-9-127.
. PMID 18334026. doi:10.1186/1471-2164-9-127. - Bürglin TR. . Genome Biology. 2008, 9 (11): 241. PMC 2614485
 . PMID 19040769. doi:10.1186/gb-2008-9-11-241.
. PMID 19040769. doi:10.1186/gb-2008-9-11-241. - Zugasti O, Rajan J, Kuwabara PE. . Genome Research. October 2005, 15 (10): 1402–10. PMC 1240083
 . PMID 16204193. doi:10.1101/gr.3935405.
. PMID 16204193. doi:10.1101/gr.3935405. - Bürglin TR, Kuwabara PE. . WormBook. January 2006: 1–14. PMC 4781598
 . PMID 18050469. doi:10.1895/wormbook.1.76.1.
. PMID 18050469. doi:10.1895/wormbook.1.76.1. - Hausmann G, von Mering C, Basler K. . PLOS Biology. June 2009, 7 (6): e1000146. PMC 2698682
 . PMID 19564910. doi:10.1371/journal.pbio.1000146.
. PMID 19564910. doi:10.1371/journal.pbio.1000146.
外部链接
| 维基共享资源上的相关多媒体资源:刺猬信号通路 |
- https://web.archive.org/web/20060716083827/http://hedgehog.sfsu.edu/(刺猬通路数据库)
- http://www.novusbio.com/hedgehogpathway.html (页面存档备份,存于) (页面存档备份,存于)(刺猬信号通路图)