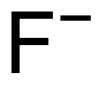氟化物
氟化物指含负价氟的有机或無機化合物。与其他卤素类似,氟生成单负阴离子(氟离子F−)。氟可与除He、Ne和Ar外的所有元素形成二元化合物。从致命毒素沙林到药品依法韦仑,从难溶的氟化钙到反应性很强的四氟化硫和三氟化氯都属于氟化物的范畴。
| 氟化物 | |||
|---|---|---|---|
| |||
| IUPAC名 Fluoride[1] | |||
| 识别 | |||
| CAS号 | 16984-48-8 | ||
| PubChem | 28179 | ||
| ChemSpider | 26214 | ||
| SMILES |
| ||
| Gmelin | 14905 | ||
| ChEBI | 17051 | ||
| KEGG | C00742 | ||
| MeSH | Fluoride | ||
| 性质 | |||
| 化学式 | F | ||
| 摩尔质量 | 19 g·mol−1 | ||
| 热力学 | |||
| ΔfHm⦵298K | −333 kJ mol−1 | ||
| S⦵298K | 145.58 J/mol K (气态)[2] | ||
| 相关物质 | |||
| 其他阴离子 | |||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
例子

无机氟化物的水溶液含有F−和氟化氢根离子HF2−。[3] 少数无机氟化物溶于水而不显著水解。无机氟化物的例子有氢氟酸(HF)、氟化钠(NaF)和六氟化铀(UF6)。从反应活性上看,氟化物与氯化物和其他卤化物有显著不同,由于半径/电荷比小的缘故而溶剂化倾向更强,更趋近于氢氧化物。Si-F键属于单键中键能较高的一类,其他硅卤化物则很容易水解。
氟化物矿物有很多,其中商业上比较重要的是萤石和氟磷灰石。在天然饮用水和食物中都有低浓度的氟化物存在,而地下水中的氟含量则要高一些。海水中平均为1.3ppm[4](1.2~1.5ppm),淡水中的则为0.01-0.3 ppm。[5]
应用
氟化物在现代科技中有重要应用。氢氟酸是制取的最重要的氟化物,主要用于氟代烃和铝氟化物的生产。此外,氢氟酸还有很多特别的应用,如利用它来溶解玻璃。[6]
酶抑制剂
生物化学中,氟化物常被用为酶抑制剂,通常用于抑制磷酸酶,例如丝氨酸/苏氨酸磷酸酶。[7] 其机理可能是替换了酶活性位点中亲核性的氢氧根。[8]氟化铍和氟化铝结构上与磷酸根相类似,其中间体可与反应的过渡态构型相竞争,因此都可用作酶抑制剂。[9][10]
含氟聚合物
含氟聚合物,例如聚四氟乙烯(即特富龙)是化学惰性且对生物无害的材料,应用于外科植入物材料中,譬如冠状动脉搭桥手术中,[11] 以及作为整容和重建外科中软组织的替代品。[12] 它也是不粘锅涂层和Gore-Tex公司户外防水透气型布料的主要材料。
口腔病防治
牙釉質是由氫氧磷酸鈣(Ca5(PO4)3OH)所組成,口腔呈酸性(pH值<5.5)時,氫氧磷酸鈣內的氫氧根離子會與口腔內的酸性成份產生酸鹼反應,造成牙釉質流失鈣質(去礦化)。氟化物能取代氫氧磷酸鈣中的氫氧根離子,而且此過程為放熱反應,所以無須輸入額外能量就能自然發生。反應後會形成不易與酸反應的氟磷酸鈣(Ca5(PO4)3F),且固定住牙釉質表面的鈣離子(再礦化)。但這層包裹牙釉質的氟磷酸鈣薄膜在咀嚼食物時會被磨損,因此需要定期為牙齒補充氟化物[13]。因為氟離子於低濃度時有抑菌作用,高濃度時有殺菌作用,世界衛生組織的報告還指出氟化物會干擾口腔致齲菌的新陳代謝與生長,降低致齲菌的產酸能力。
含氟化合物被用于预防龋齿、饮水加氟及牙膏等口腔卫生产品中。[14] 起初是用氟化钠来为饮用水加氟,但后来逐渐被氟硅酸(H2SiF6)及其盐氟硅酸钠(Na2SiF6)代替,尤其是在美国。饮水加氟可以预防龋齿,[15][16] 并被美国疾病控制与预防中心(CDC)认为是“20世纪10大公共健康成就之一”。[17] 然而在一些集中供水系统并不发达的国家,政府则采用对食盐加氟的方法来补充氟。
饮水加氟也受到过质疑,参见对饮水加氟的争议。[18]
毒性

氟化物在自然环境中难以分解,会长期积存在土壤里,最后进入到地下水源。 如果长期饮用氟化物超标的水可能会導致成年人患上血液疾病、肠炎甚至癌症。这些有害物质对儿童的危害更大,可能导致儿童患上哮喘、甲状腺激素紊乱和大脑发育不全等。消防泡沫包括有全氟辛烷磺酸。
含氟化合物在结构上可以有很大差异,因此很难概括出氟化物的一般毒性。氟化物的毒性与其反应活性和结构有关,对盐而言,则是离解出氟离子的能力。 可溶的氟化物,例如最常见的NaF,具有适度的毒性,但已有与急性中毒有关联的事故及自杀个案被报道出来。[6] 尽管最小致死剂量尚不清楚,已经有报道称4g NaF对一个成年人足以致命。[21] 少至0.2g的氟硅酸钠(Na2SiF6)及其含氟更多的化合物可以致死,时间约为5-12小时。[21] 其致毒机理为,氟离子会与血液中的钙离子结合,生成不溶的氟化钙,从而进一步造成低血钙症。由于钙对神经系统至关重要,其浓度的降低可以是致命的。相应的治疗则包括用稀氢氧化钙或氯化钙溶液以防止进一步的氟吸收,并且注射葡萄糖酸钙以补充血钙。[21]氟化氢在相比之下更加危险,因为它有腐蚀性和挥发性,因此可通过吸入或皮肤吸收进入人体造成氟中毒。葡萄糖酸钙為常用的解毒剂。[22]
有一些有机氟化物是剧毒,包括有机磷酸酯例如沙林毒氣和二异丙基氟磷酸。它们可在肌神经接合点和胆碱酯酶反应,因此阻止神经刺激向肌肉传递引致窒息息。[23] 左图中,抑制剂中反应性强的F-P键是丝氨酸活性中心残基亲核进攻的位点,反应后F−离子离去,酶则失活。
虽然聚四氟乙烯是化学惰性且无毒的,但在炊具温度超过260 °C后就会变性,并且在350 °C以上分解。[24] 这些降解产物可能对鸟类是致命的,也有可能在人类中导致类似流感的症状。[24] 相比之下,脂肪、油和黄油在200 °C以上烧焦变质,而对于肉则是在200-230 °C之间。
在一份1959年(在美国食品药品监督管理局通过食物加工器材使用之前)的研究中,表明使用普通油时,有涂层的锅干热时放出的烟较普通锅放出的毒性要小。[25]
参考文献
- . The PubChem Project. USA: National Center for Biotechnology Information. Identification. [2020-05-11]. (原始内容存档于2013-12-11).
- Chase, M. W. . NIST: 1–1951. 1998 [July 4, 2012]. (原始内容存档于2018-11-16).
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Fluoride in Drinking-water: Background document for development of WHO Guidelines for Drinking-water Quality (页面存档备份,存于). World Health Organization, 2004, page 2. Page accessed on February 22, 2007.
- Environmental Health Criteria 227: Fluorides (页面存档备份,存于). World Health Organization, 2002, page 38. Page accessed on February 22, 2007.
- Jean Aigueperse, Paul Mollard, Didier Devilliers, Marius Chemla, Robert Faron, Renée Romano, Jean Pierre Cuer, “Fluorine Compounds, Inorganic” in Ullmann’s Encyclopedia of Industrial Chemistry 2005 Wiley-VCH, Weinheim. DOI 10.1002/14356007.a11 307
- Nakai C, Thomas JA. . J. Biol. Chem. 1974, 249 (20): 6459–67. PMID 4370977.
- Schenk G, Elliott TW, Leung E; et al. . BMC Struct. Biol. 2008, 8 (1): 6 [2008-04-12]. PMID 18234116. doi:10.1186/1472-6807-8-6. (原始内容存档于2008-04-10).
- Wang W, Cho HS, Kim R; et al. . J. Mol. Biol. 2002, 319 (2): 421–31 [2008-04-12]. PMID 12051918. doi:10.1016/S0022-2836(02)00324-8. (原始内容存档于2021-08-05).
- Cho H, Wang W, Kim R; et al. . Proc. Natl. Acad. Sci. U.S.A. 2001, 98 (15): 8525–30. PMID 11438683. doi:10.1073/pnas.131213698.
- Kannan RY, Salacinski HJ, Butler PE, Hamilton G, Seifalian AM. . J. Biomed. Mater. Res. Part B Appl. Biomater. 2005, 74 (1): 570–81. PMID 15889440. doi:10.1002/jbm.b.30247.
- Singh S, Baker JL. . Clin Plast Surg. 2000, 27 (4): 579–93. PMID 11039891.
- . [2018-09-09]. (原始内容存档于2021-08-05).
- McDonagh M S, Whiting P F, Wilson P M, Sutton A J, Chestnutt I, Cooper J, Misso K, Bradley M, Treasure E, & Kleijnen J. . British Medical Journal. 2000, 321 (7265): 855–859. doi:10.1136/bmj.321.7265.855.
- Griffin SO, Regnier E, Griffin PM, Huntley V. . J. Dent. Res. 2007, 86 (5): 410–5. PMID 17452559.
- Winston AE, Bhaskar SN. . J Am Dent Assoc. 1998, 129 (11): 1579–87 [2008-04-12]. PMID 9818575. (原始内容存档于2012-07-15).
- . [2008-04-12]. (原始内容存档于2008-04-14).
- Newbrun E. . J Public Health Dent. 1996, 56 (5 Spec No): 246–52. PMID 9034969.
- Park BK, Kitteringham NR, O'Neill PM. . Annu. Rev. Pharmacol. Toxicol. 2001, 41: 443–70. PMID 11264465. doi:10.1146/annurev.pharmtox.41.1.443.
- Fisher MB, Henne KR, Boer J. . Curr Opin Drug Discov Devel. 2006, 9 (1): 101–9. PMID 16445122.
- I. M. Rabinowitch. Acute Fluoride Poisoning. Can Med Assoc J. 1945, 52, 345–349.
- Muriale L, Lee E, Genovese J, Trend S. Fatality due to acute fluoride poisoning following dermal contact with hydrofluoric acid in a palynology laboratory. Ann Occup Hyg. 1996 40, 705-710. PMID 8958774.
- Marrs TC. . Pharmacol. Ther. 1993, 58 (1): 51–66. PMID 8415873.
- DuPont, Key Questions About Teflon® (页面存档备份,存于),于03 Dec 2007查阅。
- Dale Blumenthal. . Food and Drug Administration. [2006-05-20]. (原始内容存档于2006-02-17).