铝
铝因其低密度以及耐腐蚀(由于钝化现象)而受到重视。其合金根據工藝的不同性質差異很大,利用铝及其合金制造的结构件不仅在航空航天工业中非常关键,在交通和结构材料领域也非常重要。最有用的铝化合物是它的氧化物和硫酸盐。
尽管铝在环境中广泛存在,但没有一种已知生命形式需要铝元素。
物理性质
铝是轻金属,密度为2.70 g/cm3,僅是钢的三分之一左右。使铝制零件通过它们的轻盈易于识别。[7]与大多数金属相比,铝的密度低是因为它的原子核要轻得多,而晶胞大小的差异并不能弥补这种差异。比铝的密度低的金属只有反应性太高,不能用作结构的碱金属和碱土金属(铍和镁除外,但铍有剧毒)。[8]铝不像钢那样坚固和坚硬,但在航空航天工业等应用中,低密度弥补了这一点。[9]純鋁較軟,在300℃左右失去抗張強度,熔点660.4度。經處理過的鋁合金較堅韌、易延展。有着金属光泽,光滑时表面银白而发亮,粗糙时呈暗灰色。无磁性且不易点燃。反射可见光能力强(约92%),反射中远红外线可达98%。纯铝相当软,缺乏强度。在大多数应用中,都会使用各种铝合金,因为它们具有更高的强度和硬度。[10]纯铝的屈服为7~11MPa,而铝合金可达200~600MPa。[11]铝是有延展性的,伸长率为50-70%,[12]容易拉拔和挤型。[13]它也很容易被机械加工和铸造。[13]
铝有良好的导电导热性(都为铜的59%),而远轻于铜。[14]铝可以在低于1.2K 的温度和磁通量大于100高斯下超导。[15]它是顺磁性的,因此基本上不受静磁场的影响。[16]然而,高导电性意味着它通过涡电流的感应,受到交变磁场的强烈影响。[17]
电子层
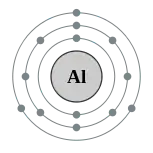
铝原子有13个电子,电子排布为 [Ne] 3s2 3p1,[18]比稳定的惰性气体氖多出三个电子。因此,铝的第一、第二和第三电离能的总和远低于第四电离能。[19]这种电子排布和其它硼族元素类似。在许多化学反应中,铝可以相对容易地释放其最外层的三个电子(见下)。铝的电负性为1.61(鲍林标度)。[20]
一个自由铝原子的原子半径为143 pm。[21]当三个价电子被移除时,Al3+的离子半径缩小到 39 pm(四配位)或 53.5 pm(六配位)。[21]在标准情况下,铝原子以面心立方晶系排列,由原子最外层电子提供的金属键结合,因此铝是一种金属。[22]许多金属都有这种晶系,例如铅和铜。铝的晶胞大小与其他金属相当。[22]然而,其它硼族元素都不是这种晶系的。硼的电离能太高而无法金属化,铊具有六方最密堆积结构,而镓和铟具有不是最密堆积的不寻常结构。铝原子可用于形成金属键的少量电子可能是它柔软、熔点低和电阻率低的原因。[23]
同位素
在所有铝同位素中,只有27
Al
是稳定的。这在原子序是奇数的元素中很常见。[lower-alpha 1]它是唯一一种原生铝同位素,也就是从地球形成到现在一直存在的同位素。地球上几乎所有的铝都是这种同位素,使得铝是一种单一天然同位素元素。铝的标准原子量几乎和铝-27的质量一样。这使得铝在核磁共振(NMR)中非常有用,因为铝-27有很高的 NMR灵敏度。[25]铝的标准原子量相较于其它金属很低,[lower-alpha 2]这对元素的属性有影响。
剩下的铝同位素都有放射性。其中最稳定的是26Al:虽然它与稳定的27Al一起存在于形成太阳系的星际介质中,也是可以通过恒星核合成产生的,但它的半衰期只有717000年,因此自行星形成以来,铝-26就全部衰变了。[27]然而,由于宇宙射线质子轰击大气层中的氩气引起散裂,会产生微量的26Al。26Al 和10Be的比例可用于放射性定年法,适用于105至106年的尺度(运输、沉积、沉积物储存、埋藏时间和侵蚀)。[28]大多数陨石学家认为,26Al衰变释放的能量是一些小行星在45.5亿年前形成后熔化和分异的原因。[29]
化学性质
铝结合了过渡金属和后过渡金属的特性。由于它几乎没有可用于金属键的电子,就像其较重的硼族元素一样,它具有后过渡金属的物理性质,原子间的距离长于预期。[23]此外,由于 Al3+是一种小而高度带电的阳离子,它具有很强的极化性。这使得铝化合物的化学键趋向于共价键。[30]这种性质和铍(Be2+)类似,它们存在对角线关系。[31]
铝的原子实的电子结构是惰性气体核心,而较重的同族元素镓、铟、铊和鿭已经有充满的d壳层,有些还有f壳层。因此,铝的内部电子几乎完全屏蔽了价电子,这与较重的同族元素不同。铝是整个硼族元素中电正性最高的元素,它的氢氧化物也比氢氧化镓的碱性更强。[30][lower-alpha 3]铝与同族的类金属硼也有细微的相似之处:AlX3和 BX3是等电子体(它们具有相同的价电子结构),并且两者都表现为路易斯酸,且很容易形成加合物。[32]
铝容易與氧反應,暴露于空气中会在其表面生成致密的氧化铝 Al2O3(此过程为钝化)薄层(室温下厚度为5纳米)[33],有效的防止其继续氧化,或是与水和稀酸反应。[30][34]由于铝具有一般的耐腐蚀性,因此它是为数不多的以细粉形式保留银色的金属之一,使其成为银色颜料的重要组成部分。[35]在常温下,铝在强氧化性酸中被钝化,不与它们反应,所以浓硝酸、浓硫酸和一些有机酸是用铝罐存放的。[36]
在热浓盐酸中,铝与水反应放出氢气,并在氢氧化钠或氢氧化钾水溶液中形成铝酸盐——在这些条件下保护性钝化可以忽略不计。[37]王水也会溶解铝。[36]铝会被溶解的氯化物腐蚀,例如常见的氯化钠,这就是为什么家用管道从不由铝制成的原因。[37]铝的氧化层会因为汞的汞齐化,或是接触电正性元素的盐而被破坏。[30]因此,由于伽凡尼电池与合金化铜的反应,最强的铝合金的耐腐蚀性较差,[11]铝的耐腐蚀性也会因含水盐的存在而大大降低,尤其是在有不同金属存在的情况下。[23]
铝和大部分非金属加热时反应,形成像是氮化铝(AlN)、硫化铝(Al2S3)和卤化铝(AlX3)的化合物。铝也可以和几乎整个周期表的元素混合,形成金属间化合物。[30]
无机化合物
大部分的铝化合物中,铝的氧化态为 +3。Al3+的配位数通常是4或6。几乎所有的铝(III)化合物都是无色的。[30]
在水溶液中,Al3+以六水合物[Al(H2O)6]3+的形式存在,Ka约为10−5。[25]这种溶液是酸性的,因为这种阳离子可以作为质子供体并逐渐水解,直到形成氢氧化铝(Al(OH)3)沉淀。
氢氧化铝可溶于酸和碱,分别形成铝盐和铝酸盐,也与酸性和碱性氧化物融合。[30]因此,Al(OH)3是两性的,为弱碱性阳离子的特征。弱碱性阳离子会形成不溶性氢氧化物,其水合物也可以提供质子。这样的一个影响是铝的弱酸盐在水中会水解成水合氢氧化物和相应的非金属氢化物。举个例子,硫化铝水解形成硫化氢。对于铝的强酸盐,如卤化铝、硝酸铝和硫酸铝,只会发生不完全水解。由于类似的原因,无水铝化合物不能由加热它们的“水合物”而成。水合氯化铝的结构不是 AlCl3·6H2O ,而是[Al(H2O)6]Cl3,且 Al–O 键是如此的强,以至于加热不足以破坏它们并形成 Al-Cl 键:[30]
- 2[Al(H2O)6]Cl3 Al2O3 + 6 HCl + 9 H2O
铝的四种三卤化物都是已知的。不像更重的三种卤化物,氟化铝(AlF3)具有六配位铝,这解释了它的不挥发性、不溶性以及高生成热。每个铝原子都被六个氟原子包围,形成扭曲八面体结构,每个氟原子则桥接在两个八面体的角之间。这些{AlF6}单元也存在于三元氟化物中,例如冰晶石Na3AlF6。AlF3的熔点是1,290 °C(2,354 °F),可以由氧化铝和氟化氢在700 °C(1,300 °F)下反应而成。[38]
铝在重卤化物中的配位数较少。这些卤化物是二聚体或多聚体,含有四配位铝中心。氯化铝(AlCl3)在熔点192.4 °C(378 °F)以下时为层状聚合物结构,在液态为 Al2Cl6二聚体。在高温下,它会分解成AlCl3单体,结构类似于BCl3。溴化铝和碘化铝在固态、液态和气态都是Al2X6二聚体,因此在改变相态时没有显著的变化。[38]它们都可以由铝和卤素直接反应而成。三卤化铝可以形成许多加合物或配合物。它们是路易斯酸,使它们可用作傅-克反应的催化剂。三氯化铝具有涉及该反应的主要工业用途,例如制造蒽醌和苯乙烯。它也经常用作其它铝化合物的前体和将非金属氟化物转化为相应氯化物的试剂(转移卤化反应)。[38]
铝形成一种稳定的氧化物——氧化铝,化学式Al2O3。[39]它在自然界中以刚玉(α-氧化铝)的形式存在。[40]γ-氧化铝也是存在的。[25]氧化铝的结晶——刚玉是非常硬的(莫氏硬度9),有着高熔点2,045 °C(3,713 °F),极低的挥发性,化学惰性,也是良好的电绝缘体。它常用于磨料(如牙膏)、耐火材料和陶瓷器,以及作为电解生产铝金属的起始材料。蓝宝石和红宝石是不纯的刚玉,里面有其它金属。[25]两种碱式氧化铝,化学式 AlO(OH)的晶体分别为勃姆石和硬水铝石。氢氧化铝有三种主要的矿物:三羟铝石、三水铝石和斜三水铝石,它们的晶体结构不同。[25]
铝有三种标准情况下稳定的硫属化物,分别为硫化铝(Al2S3)、硒化铝(Al2Se3)和碲化铝(Al2Te3)。它们三个都可以由铝的硫属元素在1,000 °C(1,800 °F)下反应而成。它们会迅速水解,形成氢氧化铝和对应的氧族元素氢化物。[41]
铝有四种氮族元素化物——氮化铝(AlN)、磷化铝(AlP)、砷化铝(AlAs)和锑化铝(AlSb)。它们都是三五半导体,和硅和锗是等电子体,除了 AlN 外,所有这些都具有闪锌矿结构。它们都可以由在高温(可能需要高压)下组成元素直接反应而成。[41]
铝和其它金属(大多数碱金属和硼族元素除外)形成的合金和150种金属互化物都是已知的。制备这些合金和金属互化物的方法包括按一定比例将金属混合加热,然后逐渐冷却和退火。它们中的键主要是金属键,晶体结构主要取决于堆积效率。[42]
铝也有一些低氧化态的化合物。一些铝(I)化合物是已知的:AlF、AlCl、AlBr和 AlI 存在于气相。它们可以由三卤化铝和金属铝加热或在低温下反应而成。[38]一种稳定的一碘化铝衍生物是它和三乙胺形成的加合物,化学式Al4I4(NEt3)4。Al2O 和Al2S 也存在,不过非常不稳定。[43]在铝金属与氧化剂的反应中会观察到非常简单的铝(II)化合物。例如,一氧化铝,化学式 AlO,已经在爆炸中[44]和恒星吸收光谱中检测到。[45]研究较彻底的铝(II)化合物的通式为 R4Al2,含有一根 Al–Al键,其中 R 是一个大的有机基团。[46]
有机铝化合物和相关的氢化物
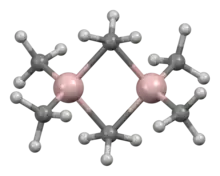
一系列实验式 AlR3和AlR1.5Cl1.5的化合物都是已知的。[47]三烷基/芳基铝都有高反应性,挥发性,外观为无色液体或低熔点固体。它们在空气中自燃并与水发生反应,因此在处理它们时需要采取预防措施。不像对应的硼化合物,有机铝化合物是二聚体。不过,如果 R基团是有支链的(例如Pri、Bui和 Me3CCH2),它就可能以单体存在。举个例子,三异丁基铝以单体和二聚体的混合物的形式存在。[48][49]这些二聚体,像是三甲基铝(Al2Me6),含有四面体型的铝中心,在两个铝原子之间有两个桥接烷基。它们硬酸,会和配体反应,形成加合物。在工业上,它们主要用于烯烃插入反应。一些杂环和簇合的有机铝化合物也是已知的,其中含有Al–N键。[48]
工业上最重要的铝氢化物是氢化铝锂(LiAlH4),在有机化学中用作还原剂。它可以由氢化锂和氯化铝反应而成。[50]最简单的铝氢化物是氢化铝,又称铝烷,比较不重要。它是一种聚合物,化学式 (AlH3)n。作为对比,最简单的硼烷是乙硼烷 (BH3)2。[50]
自然分布
太空
铝在太阳系的丰度是3.15 ppm。[51][lower-alpha 4]它是宇宙中第12多的元素,也是奇原子序的元素中第三多的,仅次于氢和氮。[51]铝唯一的稳定同位素27Al,是宇宙中第18多的核素。它几乎是在大质量恒星中的碳融合之后产生的,这些恒星后来将成为II型超新星。碳融合会产生26Mg,然后这种同位素吸收一个质子或中子,形成铝-27。较少的27Al则是在氢燃烧中,26Mg捕获一个质子而成的。[52]几乎所有的铝都是27Al,而当时存在于太阳系的26Al 的丰度为27Al的 0.005%。不过,728,000年的半衰期无法使铝-26在今天仍然存在,因此26Al灭绝了。[52]不像27Al,氢燃烧是26Al的主要来源,由25Mg 和自由质子聚合而成。不过,今天仍然存在的微量的26Al是星际物质中最常见的伽马射线发射体。[52]如果那时的26Al仍然存在,银河系的伽马射线图将会更亮。[52]
地球
整个地球由1.59%的铝组成(质量计,排在第七位)[53]地壳中的铝则更加丰富,因为它易于形成氧化物,并被束缚在岩石而留在地壳中,而活性较低的金属沉入地核。[52]在地壳中,铝是丰度最高的金属,占了 8.23%(质量计),[12],也是仅次于氧和硅,第三多的元素。[54]地壳中的大量硅酸盐含有铝。[55]相较之下,地球地幔只含2.38%的铝(质量计)。[56]铝也存在于海水中,浓度2μg/kg。[12]
由于铝对氧的高亲和性,它几乎不以游离态存在。铝通常以氧化物和硅酸盐的形式出现。长石,地壳中最常见的一类矿物,是由铝硅酸盐组成的。铝也存在于绿柱石、冰晶石、石榴石、尖晶石和绿松石中。[57]Al2O3中的杂质铬和铁会分别形成红宝石和蓝宝石。[58]游离铝金属极度稀有,并且只能在低氧逸度环境中作为次要相态被发现,例如某些火山的内部。[59]在南海东北部大陆坡的冷泉中,已经发现了游离铝。这些游离铝可能是细菌还原Al(OH)4−的产物。[60]
尽管铝是一种常见且广泛使用的元素,但并非所有铝矿都是经济上可行的金属铝的来源。几乎所有的金属铝都是从铝土矿(AlOx(OH)3–2x)生产的。铝土矿是热带气候条件下低铁和二氧化硅基岩的风化产物。[61]2017 年,大部分铝土矿在澳大利亚、中国、几内亚和印度开采。[62]
历史

铝的历史是从明矾的使用开始塑造的。古希腊历史学家希罗多德对明矾的第一个书面记录可以追溯到公元前5世纪。[63]古人曾将明矾用作媒染剂和用于城市防御。[63]十字军东征后,明矾是欧洲织物工业中不可或缺的商品,[64]也成为国际贸易的对象。[65]直到15 世纪中叶,矾才从地中海东部进口到欧洲。[66]
当时明矾的性质仍然未知。大约在1530年,瑞士医生帕拉塞尔苏斯认为明矾是矾土的盐。[67]1595年,德国医生和化学家安德烈亚斯·利巴菲乌斯用实验证实了这一点。[68]1722年,德国化学家Friedrich Hoffmann宣布了他的意见,即明矾的基础是一种独特的土。[69]1754年,德国化学家马格拉夫通过在硫酸中煮沸粘土,然后加入钾盐合成了铝土(氧化铝)。[69]
相对于其他金属,铝的发现比较晚。生产金属铝的尝试可以追溯到1760年。[70]1808年,汉弗里·戴维爵士首次使用了「aluminum」这个词,[71]并开始尝试生产铝。1825年丹麦化学家汉斯·奥斯特成功用钾汞齐从氯化铝中还原出一块看起来像锡的金属块,也就是铝[72][73][74]:

他在1825年展示了他的结果并展示了新金属的样品。[75][76]1827年,弗里德里希·维勒重复了奥斯特的实验,不过没有得到任何铝。[77](这种不一致的原因直到1921年才被发现。)[78]同年,他用金属钾还原熔融的无水氯化铝得到较纯的金属铝单质。[74]1845年,他能够生产出小块的金属铝,并描述了这种金属的一些物理特性。[78]多年后,维勒被认为是铝的发现者。[79]
由于取之不易,当时铝的价格高于黄金。[77]1856 年,法国化学家德维尔(Henri Etienne Sainte-Claire Deville)及其同伴建立了铝的第一个工业生产。[80]他发现到比钾更方便也更便宜的钠也可以还原氯化铝。[81]即便如此,铝的纯度仍然不高,而且所生产的铝的特性因样品而异。[82]
1886年,查尔斯·马丁·霍尔(Charles Martin Hall)和保罗·埃鲁(Paul Héroult)各自独立发现了电解制铝法,后来这种方法被称为霍尔-埃鲁法[83]。这种方法把氧化铝转化成金属铝。在1889年,卡尔·约瑟夫·拜耳继续了从铝土矿中提取氧化铝的过程,使得生产铝的原料氧化铝更加经济易得。[84]迄今以拜耳法与霍尔-埃鲁法联用生产铝的方法为大规模工业制铝的主要手段。[85]
铝的价格下降,之后在1890年代和20世纪初被广泛用于珠宝、日常用品、眼镜架、光学仪器、餐具和铝箔中。铝与其他金属形成坚硬而轻的合金的能力为当时的其它金属提供了多种用途。[86]在一战期间,主要政府要求将大量的铝用于坚硬而轻的机身;[87]到了二战,主要政府对于铝的这些需求更高。[88][89][90]
到了20世纪中叶,铝已成为日常生活的一部分和家庭用品的重要组成部分。[91]1954年,铝的产量超过了铜,[lower-alpha 5]历史上的总产量仅次于铁,[94]成为产量最高的有色金属。在这期间,铝作为一种土木工程材料出现,在基础建筑和室内装修中都有应用,[95]且越来越多地用于军事工程,用于飞机和陆地装甲车辆发动机。[96]第一个人造卫星于1957年发射,由两个单独的铝半球连接在一起组成,随后所有的航天器都在某种程度上使用了铝。[85]铝罐于1956年发明,1958年用作饮料的容器。[97]

在20世纪期间,铝的产量迅速上升:1900年世界铝产量为6800公吨,1916年的年产量首次突破10万吨,1941年突破100万吨,1971年则突破1000万吨。[92]1970年代,对铝的需求增加使其成为交易商品。它于1978年进入伦敦金属交易所,这是世界上最古老的工业金属交易所。[85]之后铝的产量持续增长:2013年,铝的年产量突破5000万吨。[92]
铝的实际价格从1900年的每公吨14000美元下降到1948年的每公吨2340美元(以1998年美元计)。[92]技术进步和经济规模降低了铝的提取和加工成本。然而,开发低品位、质量较差的矿床的需求以及快速增加的投入成本(主要是能源)的使用增加了铝的净成本,[98]铝的实际价格开始了1970年代随着能源成本的上升而增长。[99]铝的生产从工业化国家转移到生产成本较低的国家。[100]由于技术进步、能源价格下降、美元汇率和氧化铝的价格,20世纪后期铝的生产成本发生了变化。[101]金砖国家在初级生产和初级消费中的总份额在2000年代大幅增长。[102]得益于丰富的资源、廉价的能源和政府的刺激,中国占了世界产量特别大的份额。[103]中国的消费份额也从1972年的2%增加到2010年的40%。[104]在美国、西欧和日本,大部分的铝用于运输、工程、建筑和包装。[105]
生产和细化
铝的生产从地下提取的铝土矿开始。铝土矿使用拜耳法加工并转化为氧化铝,然后使用霍尔-埃鲁法加工,从而形成金属铝。
生产铝是高度耗能的,因此铝的生产商倾向于将冶炼厂设在电力充足且价格低廉的地方。[106]截至 2019 年,全球最大的铝冶炼厂位于中国、印度、俄罗斯、加拿大和阿拉伯联合酋长国,[107]而中国是迄今为止最大的铝生产国,占世界份额的 55%。
根据国际资源委员会的社会金属库存报告,全球平均每人在社会中使用的铝(即汽车、建筑、电子产品等)为80(180磅)。[108]
拜耳法
铝土矿通过拜耳法转化成氧化铝。将铝土矿混合均匀,然后研磨。将得到的泥浆与热氢氧化钠溶液混合,然后在远高于大气压的压力下的反应釜中处理混合物。将氢氧化铝溶解在铝土矿中,同时将杂质转化为相对不溶的化合物:[109]
在该反应之后,这些泥浆处于高于其常压沸点的温度。随着压力的降低,它通过去除蒸汽来冷却。铝土矿的残留物将从溶液中分离并丢弃。这时,溶液中不含固体,之后以小的氢氧化铝晶体为晶种,使[Al(OH)4]−离子分解成氢氧化铝。在大约一半的铝沉淀后,混合物被送到分级器。之后,收集小的氢氧化铝晶体作为晶种,而粗的氢氧化铝颗粒通过加热转化为氧化铝。多余的溶液将通过蒸发去除,纯化(如果需要),并循环使用。[109]
霍尔-埃鲁法

在把铝土矿转化成氧化铝之后,可以通过霍尔-埃鲁法变成金属铝。氧化铝、冰晶石(Na3AlF6)和氟化钙在950和980 °C(1,740和1,800 °F)的熔融混合物中电解,形成金属铝。液态铝金属会沉到溶液底部并被取出,通常浇铸成称为铝坯的大块进一步加工。[36]
电解槽的阳极由碳——最耐氟化物腐蚀的材料制成,并在过程中或过程前烘烤。前者(过程中烘烤)也称为 Söderberg 阳极,功率效率较低,并且在烘烤过程中释放的烟雾收集起来成本很高,这就是为什么它们被后者取代的原因,尽管它们节省了预前烘烤阴极的电力、能源和劳动力。用于阳极的碳最好是纯的,这样铝和电解质都不会被灰污染。尽管碳具有抗腐蚀能力,但每生产一千克铝仍以 0.4-0.5 千克的速度消耗碳。电解槽的阴极则是由无烟煤制成。它们不需要高纯度,因为杂质的浸出非常缓慢。阴极的消耗率为每千克铝 0.02-0.04 千克。电解槽的电池通常在阴极失效后 2-6 年后终止。[36]
霍尔-埃鲁法可以生产纯度超过 99%的铝。继续纯化可以通过Hoopes法实现。该过程涉及使用钠、钡和铝的氟化物电解液电解熔融的铝。在这个过程之后,铝的纯度达到 99.99%。[36][110]
电力约占铝的生产成本的20%至40%,具体取决于冶炼厂的位置。铝的生产消耗了美国大约5%的电力。[111]因此,人们研究了霍尔-埃鲁法的替代方案,但没有一个在经济上可行。[36]
低温电解法
通过在电解槽内加入氯化铝(AlCl3)和助熔剂氯酸钾、氯化钙、氯 化钠及少量的氯化锂,可以使之形成熔岩体系,让在熔融态下本不导电的氯化铝发生电解,实现较低温度下的电解法冶炼铝。该法也被视为替代电解氧化铝潜在替代,因该法“耗电省,成本低,无环境污染。”
阳极反应式
4AlCl4--2e-=2Al2Cl7-+Cl2↑
阴极反应式
4Al2Cl7-+3e-=Al+7AlCl4-
资源回收

资源回收金属已成为铝工业的一项重要任务。直到1960年代后期,回收利用一直是一项低调的活动。当时,铝制饮料罐的使用量不断增加,使公众意识到了这一点。[112]回收涉及熔化废料,这一过程仅需要用于从矿石中生产铝的5%的能量,尽管很大一部分(高达15%的输入材料)会作为灰状氧化物浪费掉。[113]铝堆熔炉产生的熔渣显着减少,报告值低于 1%。[114]
来自原铝生产和二次回收操作的浮渣仍然含有可工业提取的铝。这个过程生产铝坯以及高度复杂的废料,并且浪费很难管理。它与水反应,释放出混合气体(包括氢气、乙炔和氨),与空气接触时会自燃,[115]与潮湿空气接触会释放大量氨气。尽管存在这些问题,这些废物仍被用作沥青和混凝土的填充材料。[116]
应用
金属铝
铝在 2016年的全球产量为 5880万吨,仅次于铁(12.31亿吨)。[117][118]
铝几乎总是以合金的形式出现,这显着改善了其机械性能,尤其是回火时。例如,常见的铝箔和饮料罐都是含有92%~99%铝的合金。[119]铝主要和铜、锌、镁、锰和硅形成合金。[120]

铝金属的主要用途是:[121]
等)。
- 因为无毒(见下)、不易吸附和不易產生碎片,铝也用于包装(铝罐、箔、框架等)。
- 当需要重量轻、耐腐蚀性或工程特性很重要的情况下,铝也用于建筑和施工(窗户、门、建筑电线、护套、屋顶等)。
- 铝可用于与电力相关的用途(导体合金、电动机和发电机、变压器、电容器等),因为它相对便宜、导电性高、具有足够的机械强度和低密度、并且耐腐蚀。
- 从炊具到家具,很多家庭物品都是用铝制成的。低密度、美观、易于制造和耐用是铝制物品使用的关键因素。
- 机械设备(加工设备、管道、工具)中也会使用铝,因为它具有耐腐蚀性、不会自燃和足够的机械强度。
- 铝也用于制造便携式电脑机箱。2018年,苹果公司公开了使用使用过的饮料罐(UBC)材料来包裹其MacBook Air产品的电子元件。铝可以回收利用,清洁的铝具有剩余的市场价值。[122]
铝化合物
大部分(约 90%)的氧化铝会被转化成金属铝。[109]作为一种非常硬的材料(莫氏硬度9),[123]氧化铝被广泛用作磨料,[124]且因为极度的化学惰性,被用于高反应性环境中,像是高压钠灯中。[125]氧化铝也用作工业过程的催化剂,[109]例如催化克劳斯法(炼油厂中将硫化氢转化为硫的反应)。[126][127]许多工业催化剂是由氧化铝负担的,这意味着昂贵的催化剂材料会分散在惰性氧化铝的表面上。[128]氧化铝的另一个主要用途是作为干燥剂或吸收剂。[109][129]

铝的各种硫酸盐具有工业和商业应用。硫酸铝的水合物的年生产规模达到了数百万吨。[130]其中,约三分之二的硫酸铝用于水处理。[130]硫酸铝的另一个主要应用是造纸。[130]它还用作媒染剂,用于染色、酸洗种子、为矿物油除臭、鞣制皮革,以及生产其他铝化合物。[130]两种矾,铵明矾和明矾, 以前用于媒染和皮革鞣制,但随着高纯度硫酸铝的出现,它们的使用量显着下降。[130]无水的氯化铝在化学和石化工业、染色工业以及合成各种无机和有机化合物中用作催化剂。[130]铝酸钠可用于水处理和水泥凝固的促进剂。[130]
许多铝化合物都有应用,例如:
- 乙酸铝的溶液是一类收敛剂。[131]
- 磷酸铝可用于制造玻璃、陶瓷、木浆和纸制品、化妆品、油漆、油光漆和牙科水泥。[132]
- 氢氧化铝是一种抗酸药和媒染剂。它也用于水净化、玻璃和陶瓷的制造以及织物的防水。[133][134]
- 氢化铝锂是一种强还原剂,用于有机化学。[135][136]
- 有机铝化合物是一类路易斯酸和助催化剂。[137]
- 聚甲基铝氧烷可用于生产乙烯基聚合物,例如聚乙烯。[138]
- 水合铝离子(如水合硫酸铝)用于对付鱼类寄生虫,如Gyrodactylus salaris。[139]
- 在许多疫苗中,某些铝盐作为免疫佐剂(免疫反应增强剂),使疫苗中的蛋白质发挥足够的免疫刺激作用。[140]
对人体的影响
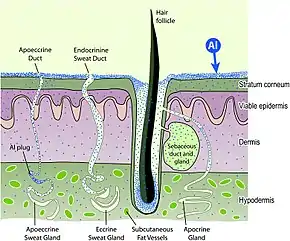
尽管铝广泛存在于地壳,它没有已知的生物作用。[36]在pH值 6-9(大多数天然水的pH值)时,铝会以氢氧化物的形式从水中沉淀出来,因此无法使用。大多数具有这种行为的元素没有生物作用,或是有毒。[142]硫酸铝的LD50为6207 mg/kg(小鼠,口服),相当于一个70(150磅)的人的半数致死量为435克,[36]尽管致死性和神经毒性的含义不同。[143]Andrási 等人发现,阿尔茨海默病症患者的尸检与没有阿尔茨海默症的受试者比较时,某些大脑区域的铝含量“显着更高”。[144]铝会和草甘膦写成螯合物。[145]
毒性
美国卫生与公共服务部将铝归类为非致癌物质。[146][lower-alpha 6]1988年发表的一篇评论说,几乎没有证据表明正常接触铝会对健康成人构成风险,[149]2014年的多元素毒理学审查则未能发现每公斤体重消耗量不超过40毫克/天的铝的有害影响。[146]大多数消耗的铝会留在粪便中,进入血液的小部分铝大部分将通过尿液排出。[150]尽管如此,一些铝确实可以通过血脑屏障,并优先留在阿尔茨海默病患者的大脑中。[151][152]1989年发表的证据似乎表明,对于阿尔茨海默病患者,铝可能通过静电与蛋白质交叉链接,从而调降颞上回中的基因。[153]
效果
虽然很少见,但铝会导致维生素D抗性的骨质软化,促红细胞生成素抗性的小细胞性贫血和中枢神经系统改变。肾功能不全的人尤其处于危险之中。[146]长期摄入水合硅酸铝(用于控制胃酸过多)可能会导致铝与肠内容物结合,并增加其他金属的排除,例如铁或锌。足够高的铝(>50克/天)会导致贫血。[146]
在1988年卡姆尔福德水污染事件期间,卡姆尔福德的人们的饮用水被硫酸铝污染了几个星期。2013年对该事件的最终报告得出结论,这不太可能导致长期的健康问题。[154]
铝被怀疑是阿尔茨海默病的可能原因,[155]但四十多年来对此的研究发现,截至2018年,没有很好的因果关系证据。[156][157]
在实验室培养的人类乳腺癌细胞中,铝会增加与雌激素相关的基因表达。[158]在非常高的剂量下,铝与血脑屏障的功能改变有关。[159]一小部分的人[160]接触铝会过敏,并在接触含铝产品后出现发痒的红疹、头痛、肌肉疼痛、关节痛、记忆力差、失眠、抑郁、哮喘、肠易激综合征或其他症状。[161]
接触途径
食物是铝的主要来源。饮用水比固体食物含有更多的铝。[146]然而,食物中的铝可能比从水中吸收的铝更多。[165]人类口服铝的主要来源包括食物(由于其用于食品添加剂、食品和饮料包装以及炊具)、饮用水(由于其用于市政水处理)和含铝药物(特别是抗酸药、抗溃疡和缓冲阿司匹林制剂)。[166]欧洲人铝的膳食暴露平均为 0.2–1.5 毫克/公斤/周,但可能高达 2.3 毫克/公斤/周。[146]较高的铝暴露水平主要限于矿工、铝生产工人和透析患者。[167]
抗酸药、止汗剂、疫苗和化妆品的消费提供了可能的铝接触途径。[168]食用含铝的酸性食物或液体可增强铝的吸收[169],而麦芽酚已被证明可以增加铝在神经和骨组织中的积累。[170]
对环境的影响

矿区附近的铝含量很高,少量的铝则在燃煤发电厂或焚化炉中释放到环境中。[173]空气中的铝通常会沉淀下来,或被雨水冲走,但小颗粒的铝会长时间留在空气中。[173]
酸性沉淀是从天然来源中调动铝的主要自然因素[146],也是铝对环境产生影响的主要原因。[174]然而,盐水和淡水中铝存在的主要因素是工业过程将铝释放到空气中。[146]
当水呈酸性时,铝会成为用鳃呼吸的动物(如鱼)的毒剂,其中铝可能会沉淀在鳃上,[175]这会导致血浆和血淋巴离子的损失,从而导致渗透调节失败。[174]铝的有机配合物可能很容易被吸收,并干扰哺乳动物和鸟类的新陈代谢,尽管这实际上很少发生。[174]
虽然铝在pH值中性土壤中难溶并且对植物一般是无害的,但它在酸性土壤中是减缓植物生长的首要因素。在酸性土壤中,Al3+阳离子浓度会升高,并影响植物的根部生长和功能。[176][177][178][179]绝大多数酸性土壤中铝(而不是氢)是饱和的。因此,土壤的酸度来源于铝化合物的水解。[180]“修正石灰位”的概念[181]是用来定义土壤中碱饱和的程度。在土壤测试实验室中,这个概念成为了确定土壤的“石灰需求”[182]的测试程序的基础。[183]小麦对铝具有适应耐受性,会释放有机化合物,与有害的铝阳离子结合。高粱被认为具有相同的耐受机制。[184]
铝在生产过程的每一步都对环境是挑战。它的主要挑战是温室气体排放。[167]这些气体来自冶炼厂的电力消耗和加工副产品。其中,最持久的是来自冶炼过程的碳氟化合物。[167]它产生的二氧化硫是酸雨的主要前体之一。[167]
一份来自2001年的西班牙科学报告声称真菌白地黴会消耗光碟中的铝。[185][186]其他报告都参考了该报告,并且没有支持原始研究。更好的记录表明,细菌铜绿假单胞菌和真菌枝孢菌通常在使用煤油燃料(不是航空汽油)的飞机油箱中检测到。实验室的培养物可以降解铝。[187]然而,这些生命形式不会直接攻击或消耗铝;相反,金属铝会被微生物的废物腐蚀。[188]
注释
- 只有少數原子序是奇数的元素有超过两个稳定同位素,而原子序为偶数的元素具有多种稳定同位素,锡(元素50)在所有元素中的稳定同位素数量最多,有十个。唯一的例外是铍,它的原子序是偶数但只有一种稳定同位素。[24]参见奇数和偶数原子核来获得更多详情。
- 大多数其它金属具有更大的标准原子量:例如,铁的原子量是55.8、铜63.5、铅207.2。 [26]
- 事实上,铝的电正性、对氧的高亲和力和高负值的标准电极电势都与钪、钇、镧和锕相似,它们像铝一样在惰性气体核心外具有三个价电子,显示出连续的趋势。然而,硼族元素的趋势被镓添加的 d壳层和由此产生的d区块收缩和铊添加的 f壳层以及由此产生的镧系收缩打破。[30]
- 来源中的丰度是相对于硅而不是按粒子表示法列出的。在定义硅为106时,所有元素的总和为 2.6682×1010,其中铝就是其中的 8.410×104。
- 比较USGS给出的铝[92]和铜[93]的年产量
- 虽然铝本身不致癌,但国际癌症研究机构特别指出Söderberg铝生产,[147]可能是由于暴露于多环芳香烃。[148]
参考资料
- Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. . Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- . Los Alamos National Laboratory. [2013-03-03]. (原始内容存档于2012-08-04).
- Dohmeier, C.; Loos, D.; Schnöckel, H. . Angewandte Chemie International Edition. 1996, 35 (2): 129–149. doi:10.1002/anie.199601291.
- D. C. Tyte. . Nature. 1964, 202 (4930): 383. Bibcode:1964Natur.202..383T. S2CID 4163250. doi:10.1038/202383a0.
- Lide, D. R. . (PDF) 81st. CRC Press. 2000. ISBN 0849304814. (原始内容 (PDF)存档于2011-03-03).
- Shakhashiri, B. Z. (PDF). SciFun.org. University of Wisconsin. 2008-03-17 [2012-03-04]. (原始内容 (PDF)存档于2012年5月9日).
- Lide 2004,第4-3頁.
- Puchta, Ralph. . Nature Chemistry. 2011, 3 (5): 416. Bibcode:2011NatCh...3..416P. PMID 21505503. doi:10.1038/nchem.1033.
- Davis 1999,第1–3頁.
- Davis 1999,第2頁.
- Polmear, I.J. 3. Butterworth-Heinemann. 1995. ISBN 978-0-340-63207-9.
- Cardarelli, François. 2nd. London: Springer. 2008: 158–163. ISBN 978-1-84628-669-8. OCLC 261324602.
- Davis 1999,第4頁.
- Davis 1999,第2–3頁.
- Cochran, J.F.; Mapother, D.E. . Physical Review. 1958, 111 (1): 132–142. Bibcode:1958PhRv..111..132C. doi:10.1103/PhysRev.111.132.
- Schmitz 2006,第6頁.
- Schmitz 2006,第161頁.
- Dean 1999,第4.2頁.
- Dean 1999,第4.6頁.
- Dean 1999,第4.29頁.
- Dean 1999,第4.30頁.
- Enghag, Per. . John Wiley & Sons. 2008: 139, 819, 949 [2017-12-07]. ISBN 978-3-527-61234-5. (原始内容存档于2019-12-25).
- Greenwood & Earnshaw 1997,第222–4頁.
- IAEA – Nuclear Data Section. . www-nds.iaea.org. International Atomic Energy Agency. 2017 [2017-03-31]. (原始内容存档于2019-03-23).
- Greenwood & Earnshaw 1997,第242–252頁.
- Meija, Juris; et al. . Pure and Applied Chemistry. 2016, 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- . The Commission on Isotopic Abundances and Atomic Weights. [2020-10-20]. (原始内容存档于2020-09-23).
- Dickin, A.P. . . Cambridge University Press. 2005 [2008-07-16]. ISBN 978-0-521-53017-0. (原始内容存档于2008-12-06).
- Dodd, R.T. . Harvard University Press. 1986: 89–90. ISBN 978-0-674-89137-1.
- Greenwood & Earnshaw 1997,第224–227頁.
- Greenwood & Earnshaw 1997,第112–113頁.
- King 1995,第241頁.
- Hatch, John E. . Aluminum Association., American Society for Metals. Metals Park, Ohio: American Society for Metals. 1984: 242. ISBN 978-1-61503-169-6. OCLC 759213422.
- Vargel, Christian. . Elsevier. 2004 [French edition published 1999]. ISBN 978-0-08-044495-6. (原始内容存档于2016-05-21).
- Macleod, H.A. . CRC Press. 2001: 158159. ISBN 978-0-7503-0688-1.
- Frank, W.B. . . Wiley-VCH. 2009. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a01_459.pub2.
- Beal, Roy E. . ASTM International. 1999: 90. ISBN 978-0-8031-2610-7. (原始内容存档于24 April 2016).
- Greenwood & Earnshaw 1997,第233–237頁.
- Eastaugh, Nicholas; Walsh, Valentine; Chaplin, Tracey; Siddall, Ruth. . Routledge. 2008 [2020-10-01]. ISBN 978-1-136-37393-0. (原始内容存档于2021-04-15) (英语).
- Roscoe, Henry Enfield; Schorlemmer, Carl. . Macmillan. 1913 [2020-10-01]. (原始内容存档于2021-04-15) (英语).
- Greenwood & Earnshaw 1997,第252–257頁.
- Downs, A. J. . Springer Science & Business Media. 1993: 218 [2020-10-01]. ISBN 978-0-7514-0103-5. (原始内容存档于2021-04-15) (英语).
- Dohmeier, C.; Loos, D.; Schnöckel, H. . Angewandte Chemie International Edition. 1996, 35 (2): 129–149. doi:10.1002/anie.199601291.
- Tyte, D.C. . Nature. 1964, 202 (4930): 383–384. Bibcode:1964Natur.202..383T. S2CID 4163250. doi:10.1038/202383a0.
- Merrill, P.W.; Deutsch, A.J.; Keenan, P.C. . The Astrophysical Journal. 1962, 136: 21. Bibcode:1962ApJ...136...21M. doi:10.1086/147348.
- Uhl, W. . . Advances in Organometallic Chemistry 51. 2004: 53–108. ISBN 978-0-12-031151-4. doi:10.1016/S0065-3055(03)51002-4.
- Elschenbroich, C. . Wiley-VCH. 2006. ISBN 978-3-527-29390-2.
- Greenwood & Earnshaw 1997,第257–67頁.
- Smith, Martin B. . Journal of Organometallic Chemistry. 1970, 22 (2): 273–281. doi:10.1016/S0022-328X(00)86043-X.
- Greenwood & Earnshaw 1997,第227–232頁.
- Lodders, K. (PDF). The Astrophysical Journal. 2003, 591 (2): 1220–1247 [2018-06-15]. Bibcode:2003ApJ...591.1220L. ISSN 0004-637X. doi:10.1086/375492. (原始内容存档 (PDF)于2019-04-12).
- Clayton, D. . Leiden: Cambridge University Press. 2003: 129–137 [2020-09-13]. ISBN 978-0-511-67305-4. OCLC 609856530. (原始内容存档于2021-06-11).
- William F McDonough The composition of the Earth. quake.mit.edu, archived by the Internet Archive Wayback Machine.
- Greenwood & Earnshaw 1997,第217–9頁.
- Wade, K.; Banister, A.J. . Elsevier. 2016: 1049 [2018-06-17]. ISBN 978-1-4831-5322-3. (原始内容存档于2019-11-30).
- Palme, H.; O'Neill, Hugh St. C. (PDF). Carlson, Richard W. (编). . Elseiver. 2005: 14 [2021-06-11]. (原始内容存档 (PDF)于2021-04-03).
- Downs, A.J. . Springer Science & Business Media. 1993 [2017-06-14]. ISBN 978-0-7514-0103-5. (原始内容存档于2020-07-25) (英语).
- Kotz, John C.; Treichel, Paul M.; Townsend, John. . Cengage Learning. 2012: 300 [2018-06-17]. ISBN 978-1-133-42007-1. (原始内容存档于2019-12-22).
- Barthelmy, D. . Mineralogy Database. [2008-07-09]. (原始内容存档于2008-07-04).
- Chen, Z.; Huang, Chi-Yue; Zhao, Meixun; Yan, Wen; Chien, Chih-Wei; Chen, Muhong; Yang, Huaping; Machiyama, Hideaki; Lin, Saulwood. . Journal of Asian Earth Sciences. 2011, 40 (1): 363–370. Bibcode:2011JAESc..40..363C. doi:10.1016/j.jseaes.2010.06.006.
- Guilbert, J.F.; Park, C.F. . W.H. Freeman. 1986: 774–795. ISBN 978-0-7167-1456-9.
- United States Geological Survey. (PDF). Mineral Commodities Summaries. 2018 [2018-06-17]. (原始内容存档 (PDF)于2018-03-11).
- Drozdov 2007,第12頁.
- Clapham, John Harold; Power, Eileen Edna. . CUP Archive. 1941: 207. ISBN 978-0-521-08710-0.
- Drozdov 2007,第16頁.
- Setton, Kenneth M. . American Philosophical Society. 1976. ISBN 978-0-87169-127-9. OCLC 165383496.
- Drozdov 2007,第25頁.
- Weeks, Mary Elvira. 1 7. Journal of chemical education. 1968: 187. ISBN 9780608300177.
- Richards 1896,第2頁.
- Richards 1896,第3頁.
- Davy, Humphry. . Philosophical Transactions of the Royal Society. 1808, 98: 353 [2009-12-10]. Bibcode:1808RSPT...98..333D. doi:10.1098/rstl.1808.0023
 . (原始内容存档于2021-04-15).
. (原始内容存档于2021-04-15). - Örsted, H. C. [Overview of the Royal Danish Science Society's Proceedings and the Work of its Members, from 31 May 1824 to 31 May 1825]: 15–16. 1825 [2020-02-27]. (原始内容存档于2020-03-16) (丹麦语).
- Royal Danish Academy of Sciences and Letters. [The philosophical and historical dissertations of the Royal Danish Science Society]. Popp. 1827: xxv–xxvi [2016-03-11]. (原始内容存档于2017-03-24) (丹麦语).
- Wöhler, Friedrich. . Annalen der Physik und Chemie. 2. 1827, 11 (9): 146–161 [2016-03-11]. Bibcode:1828AnP....87..146W. doi:10.1002/andp.18270870912. (原始内容存档于2021-06-11).
- Drozdov 2007,第36頁.
- Fontani, Marco; Costa, Mariagrazia; Orna, Mary Virginia. . Oxford University Press. 2014: 30. ISBN 978-0-19-938334-4.
- Venetski, S. . Metallurgist. 1969, 13 (7): 451–453. S2CID 137541986. doi:10.1007/BF00741130.
- Drozdov 2007,第38頁.
- Holmes, Harry N. . The Scientific Monthly. 1936, 42 (3): 236–239. Bibcode:1936SciMo..42..236H. JSTOR 15938.
- Drozdov 2007,第39頁.
- Sainte-Claire Deville, H.E. . Paris: Mallet-Bachelier. 1859. (原始内容存档于2016-04-30).
- Drozdov 2007,第46頁.
- Drozdov 2007,第55–61頁.
- Drozdov 2007,第74頁.
- . All about aluminium. [2017-11-07]. (原始内容存档于2017-11-07).
- Drozdov 2007,第64–69頁.
- Ingulstad, Mats. . Ingulstad, Mats; Frøland, Hans Otto (编). . Tapir Academic Press. 2012: 33–68 [2020-05-07]. ISBN 978-82-321-0049-1. (原始内容存档于2020-07-25).
- Seldes, George. 5. In Fact, Inc. 1943: 261.
- Thorsheim, Peter. . Cambridge University Press. 2015: 66–69 [2021-01-07]. ISBN 978-1-107-09935-7. (原始内容存档于2020-04-06).
- Weeks, Albert Loren. . Lexington Books. 2004: 135 [2021-01-07]. ISBN 978-0-7391-0736-2. (原始内容存档于2020-04-06).
- Drozdov 2007,第69–70頁.
- . (报告). United States Geological Survey. 2017 [9 November 2017]. (原始内容存档于8 March 2018) (英语).
- . (报告). United States Geological Survey. 2017 [2019-06-04]. (原始内容存档于2018-03-08) (英语).
- Gregersen, Erik. . Encyclopedia Britannica. [2019-06-04]. (原始内容存档于2019-06-22) (英语).
- Drozdov 2007,第165–166頁.
- Drozdov 2007,第85頁.
- Drozdov 2007,第135頁.
- Nappi 2013,第9頁.
- Nappi 2013,第9–10頁.
- Nappi 2013,第10頁.
- Nappi 2013,第14–15頁.
- Nappi 2013,第17頁.
- Nappi 2013,第20頁.
- Nappi 2013,第22頁.
- Nappi 2013,第23頁.
- Brown, T.J. . British Geological Survey. 2009 [2014-12-01]. (原始内容存档于2019-07-13).
- (PDF). minerals.usgs.gov. [2020-12-17]. doi:10.3133/70194932. (原始内容存档 (PDF)于2021-01-22) (英语).
- Graedel, T.E.; et al. (PDF) (报告). International Resource Panel: 17. 2010 [18 April 2017]. ISBN 978-92-807-3082-1. (原始内容存档 (PDF)于26 April 2018).
- Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J.; et al. . . Wiley-VCH. 2005.
- Totten, G.E.; Mackenzie, D.S. . Marcel Dekker. 2003: 40. ISBN 978-0-8247-4843-2. (原始内容存档于2016-06-15).
- Emsley, John. . OUP Oxford. 2011: 24–30 [2017-11-16]. ISBN 978-0-19-960563-7. (原始内容存档于2019-12-22).
- Schlesinger, Mark. . CRC Press. 2006: 248 [2018-06-25]. ISBN 978-0-8493-9662-5. (原始内容存档于2017-02-15).
- . Ohio Department of Natural Resources. (原始内容存档于2003-06-24).
- (PDF). [2013-10-28]. (原始内容 (PDF)存档于2013-10-31).
- . www.experts123.com. (原始内容存档于2012-11-14).
- Dunster, A.M.; et al. (PDF). Waste & Resources Action Programme. 2005. (原始内容存档于2010-04-02).
- Brown, T.J.; Idoine, N.E.; Raycraft, E.R.; et al. . British Geological Survey. 2018 [2018-07-10]. ISBN 978-0-85272-882-6. (原始内容存档于2020-05-16).
- . . [6 March 2012]. (原始内容存档于12 March 2012).
- Millberg, L.S. . How Products are Made. [2007-08-11]. (原始内容存档于2007-07-13).
|volume=被忽略 (帮助) - Lyle, J.P.; Granger, D.A.; Sanders, R.E. . . Wiley-VCH. 2005. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a01_481.
- Davis 1999,第17–24頁.
- . Patenly Apple. March 2021 [2021-05-24]. (原始内容存档于2021-05-24).
- Lumley, Roger. . Elsevier Science. 2010: 42 [2018-07-13]. ISBN 978-0-85709-025-6. (原始内容存档于2019-12-22).
- Mortensen, Andreas. . Elsevier. 2006: 281 [2018-07-13]. ISBN 978-0-08-052462-7. (原始内容存档于2019-12-20).
- The Ceramic Society of Japan. . Springer Science & Business Media. 2012: 541 [2018-07-13]. ISBN 978-4-431-54108-0. (原始内容存档于2019-11-29).
- Slesser, Malcolm. . Palgrave Macmillan UK. 1988: 138 [2018-07-13]. ISBN 978-1-349-19476-6. (原始内容存档于2021-06-11).
- Supp, Emil. . Springer Science & Business Media. 2013: 164–165 [2018-07-13]. ISBN 978-3-662-00895-9. (原始内容存档于2019-12-26).
- Ertl, Gerhard; Knözinger, Helmut; Weitkamp, Jens. . John Wiley & Sons. 2008: 80 [2018-07-13]. ISBN 978-3-527-62068-5. (原始内容存档于2019-12-24).
- Armarego, W.L.F.; Chai, Christina. . Butterworth-Heinemann. 2009: 73, 109, 116, 155 [2018-07-13]. ISBN 978-0-08-087824-9. (原始内容存档于2019-12-22).
- Helmboldt, O. . . Wiley-VCH. 2007. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a01_527.pub2.
- World Health Organization. Stuart MC, Kouimtzi M, Hill SR , 编. . World Health Organization. 2009. ISBN 9789241547659. hdl:10665/44053
 .
. - . Grune & Stratton. 1983 [2017-06-14]. ISBN 978-0-8089-1494-5. (原始内容存档于2021-04-15) (英语).
- Galbraith, A; Bullock, S; Manias, E; Hunt, B; Richards, A. . Harlow: Pearson. 1999: 482.
- Papich, Mark G. . 2nd. St. Louis, Mo: Saunders/Elsevier. 2007: 15–16. ISBN 978-1-4160-2888-8.
- Brown, Weldon G., John Wiley & Sons, Inc. , 编, , Organic Reactions (Hoboken, NJ, USA: John Wiley & Sons, Inc.), 2011-03-15: 469–510 [2021-05-22], ISBN 978-0-471-26418-7, doi:10.1002/0471264180.or006.10, (原始内容存档于2021-06-11) (英语)
- Gerrans, G.C.; Hartmann-Petersen, P. . . New Africa Books: 143. 2007 [6 September 2017]. ISBN 978-1-86928-384-1. (原始内容存档于23 August 2017).
- M. Witt; H.W. Roesky. (PDF). Curr. Sci. 2000, 78 (4): 410. (原始内容 (PDF)存档于2014-10-06).
- A. Andresen; H.G. Cordes; J. Herwig; W. Kaminsky; A. Merck; R. Mottweiler; J. Pein; H. Sinn; H.J. Vollmer. . Angew. Chem. Int. Ed. 1976, 15 (10): 630–632. doi:10.1002/anie.197606301.
- Aas, Øystein; Klemetsen, Anders; Einum, Sigurd; et al. . John Wiley & Sons. 2011: 240 [2018-07-14]. ISBN 978-1-4443-4819-4. (原始内容存档于2019-12-21).
- Singh, Manmohan. . John Wiley & Sons. 2007: 81–109 [2018-07-14]. ISBN 978-0-470-13492-4. (原始内容存档于2019-12-20).
- Exley, C. . Environmental Science: Processes & Impacts. 2013, 15 (10): 1807–1816. PMID 23982047. doi:10.1039/C3EM00374D
 .
. - . Western Oregon University. Western Oregon University. [30 September 2019]. (原始内容存档于11 December 2018).
- Shaw, Christopher A.; Seneff, Stephanie; Kette, Stephen D.; Tomljenovic, Lucija; Oller, John W.; Davidson, Robert M. . Journal of Toxicology. 2014, 2014: 1–27. PMC 4202242
 . PMID 25349607. doi:10.1155/2014/491316
. PMID 25349607. doi:10.1155/2014/491316  .
. - Andrási, Erzsébet; Páli, Noémi; Molnár, Zsuzsa; Kösel, Siegfried. . Journal of Alzheimer's Disease. 2005, 7 (4): 273–284. PMID 16131728. doi:10.3233/jad-2005-7402.
- Purgel, Mihály; Takács, Zoltán; Jonsson, Caroline M.; Nagy, Lajos; Andersson, Ingegärd; Bányai, István; Pápai, Imre; Persson, Per; Sjöberg, Staffan; Tóth, Imre. . 10.1016/J.jinorgbio.2009.06.011. 2009, 103 (11): 1426–1438. PMID 19766319. doi:10.1016/j.jinorgbio.2009.06.011.
- Dolara, Piero. . International Journal of Food Sciences and Nutrition. 21 July 2014, 65 (8): 911–924. ISSN 1465-3478. PMID 25045935. S2CID 43779869. doi:10.3109/09637486.2014.937801.
- . International Agency for Research on Cancer. International Agency for Research on Cancer. 1984: 51–59 [7 January 2021]. ISBN 92-832-1534-6. OCLC 11527472. (原始内容存档于11 June 2021).
- Wesdock, J. C.; Arnold, I. M. F. . Journal of Occupational and Environmental Medicine. 2014, 56 (5 Suppl): S5–S11. ISSN 1076-2752. PMC 4131940
 . PMID 24806726. doi:10.1097/JOM.0000000000000071 (美国英语).
. PMID 24806726. doi:10.1097/JOM.0000000000000071 (美国英语). - . Aluminum and Health (CRC Press). 1988: 90. ISBN 0-8247-8026-4. (原始内容存档于19 May 2016).
- . www.atsdr.cdc.gov. [2018-07-18]. (原始内容存档于12 December 2016) (英语).
- Xu, N.; Majidi, V.; Markesbery, W. R.; Ehmann, W. D. . Neurotoxicology. 1992, 13 (4): 735–743. PMID 1302300.
- Yumoto, Sakae; Kakimi, Shigeo; Ohsaki, Akihiro; Ishikawa, Akira. . Journal of Inorganic Biochemistry. 2009, 103 (11): 1579–1584. PMID 19744735. doi:10.1016/j.jinorgbio.2009.07.023.
- Crapper Mclachlan, D.R.; Lukiw, W.J.; Kruck, T.P.A. . Canadian Journal of Neurological Sciences. 1989, 16 (4 Suppl): 490–497. PMID 2680008. doi:10.1017/S0317167100029826.
- (PDF). Committee on Toxicity of Chemicals in Food, Consumer Products and the Environment. 18 April 2013 [21 December 2019]. (原始内容存档 (PDF)于21 December 2019).
- Tomljenovic, Lucija. . Journal of Alzheimer's Disease. 2011-03-21, 23 (4): 567–598 [11 June 2021]. PMID 21157018. doi:10.3233/JAD-2010-101494. (原始内容存档于11 June 2021).
- . Alzheimer Society Canada. 24 August 2018 [21 December 2019]. (原始内容存档于21 December 2019).
- Santibáñez, Miguel; Bolumar, Francisco; García, Ana M. . Occupational and Environmental Medicine. 2007, 64 (11): 723–732. ISSN 1351-0711. PMC 2078415
 . PMID 17525096. doi:10.1136/oem.2006.028209.
. PMID 17525096. doi:10.1136/oem.2006.028209. - Darbre, P.D. . Journal of Applied Toxicology. 2006, 26 (3): 191–197. PMID 16489580. S2CID 26291680. doi:10.1002/jat.1135.
- Banks, W.A.; Kastin, A.J. . Neurosci Biobehav Rev. 1989, 13 (1): 47–53. PMID 2671833. S2CID 46507895. doi:10.1016/S0149-7634(89)80051-X.
- Bingham, Eula; Cohrssen, Barbara. . John Wiley & Sons. 2012: 244 [23 July 2018]. ISBN 978-0-470-41081-3. (原始内容存档于20 December 2019).
- . Allergy-symptoms.org. 2016-09-20 [2018-07-23]. (原始内容存档于23 July 2018) (美国英语).
- al-Masalkhi, A.; Walton, S.P. . The Journal of the Kentucky Medical Association. 1994, 92 (2): 59–61. ISSN 0023-0294. PMID 8163901.
- . www.cdc.gov. [11 June 2015]. (原始内容存档于30 May 2015).
- . www.cdc.gov. [11 June 2015]. (原始内容存档于30 May 2015).
- Yokel R.A.; Hicks C.L.; Florence R.L. . Food and Chemical Toxicology. 2008, 46 (6): 2261–2266. PMC 2449821
 . PMID 18436363. doi:10.1016/j.fct.2008.03.004.
. PMID 18436363. doi:10.1016/j.fct.2008.03.004. - United States Department of Health and Human Services. (PDF) (报告). 1999 [2018-08-03]. (原始内容存档 (PDF)于9 May 2020).
- . The Environmental Literacy Council. [2018-07-29]. (原始内容存档于27 October 2020) (美国英语).
- Chen, Jennifer K.; Thyssen, Jacob P. . Springer. 2018: 333 [23 July 2018]. ISBN 978-3-319-58503-1. (原始内容存档于26 December 2019).
- Slanina, P.; French, W.; Ekström, L.G.; Lööf, L.; Slorach, S.; Cedergren, A. . Clinical Chemistry. 1986, 32 (3): 539–541. PMID 3948402. doi:10.1093/clinchem/32.3.539.
- Van Ginkel, M.F.; Van Der Voet, G.B.; D'haese, P.C.; De Broe, M.E.; De Wolff, F.A. . The Journal of Laboratory and Clinical Medicine. 1993, 121 (3): 453–460. PMID 8445293.
- . www.arltma.com. [2018-07-24]. (原始内容存档于31 August 2019).
- Aluminum Toxicity 的存檔,存档日期3 February 2014. from NYU Langone Medical Center. Last reviewed November 2012 by Igor Puzanov, MD
- . www.atsdr.cdc.gov. [2018-07-28]. (原始内容存档于12 December 2016) (英语).
- Rosseland, B.O.; Eldhuset, T.D.; Staurnes, M. . Environmental Geochemistry and Health. 1990, 12 (1–2): 17–27. ISSN 0269-4042. PMID 24202562. S2CID 23714684. doi:10.1007/BF01734045.
- Baker, Joan P.; Schofield, Carl L. . Water, Air, and Soil Pollution. 1982, 18 (1–3): 289–309 [27 December 2020]. Bibcode:1982WASP...18..289B. ISSN 0049-6979. S2CID 98363768. doi:10.1007/BF02419419. (原始内容存档于11 June 2021) (英语).
- Belmonte Pereira, Luciane; Aimed Tabaldi, Luciane; Fabbrin Gonçalves, Jamile; Jucoski, Gladis Oliveira; Pauletto, Mareni Maria; Nardin Weis, Simone; Texeira Nicoloso, Fernando; Brother, Denise; Batista Teixeira Rocha, João; Chitolina Schetinger, Maria Rosa Chitolina. . Environmental and experimental botany. 2006, 57 (1–2): 106–115. doi:10.1016/j.envexpbot.2005.05.004.
- Andersson, Maud. . Water, Air, & Soil Pollution. 1988, 39 (3–4): 439–462. doi:10.1007/BF00279487.
- Horst, Walter J. . Zeitschrift für Pflanzenernährung und Bodenkunde. 1995, 158 (5): 419–428. doi:10.1002/jpln.19951580503.
- Ma, Jian Feng; Ryan, PR; Delhaize, E. . Trends in Plant Science. 2001, 6 (6): 273–278. PMID 11378470. doi:10.1016/S1360-1385(01)01961-6.
- Turner, R.C. and Clark J.S. . Trans. Comm. II & IV Int. Soc. Soil Science. 1966: 208–215.
- . Sis.agr.gc.ca. 2008-11-27 [2010-05-03]. (原始内容存档于2012-02-04).
- Turner, R.C. . Research Branch, Department Of Agriculture. 1965 [2013-09-30]. (原始内容存档于2012-07-09).
- 应用石灰来降低铝对植物的毒性。. Historical series / Agriculture Canada – Série historique / Agriculture Canada. Government of Canada. [2008-12-22]. (原始内容存档于2009-07-28).
- Magalhaes, J.V.; Garvin, D.F.; Wang, Y.; Sorrells, M.E.; Klein, P.E.; Schaffert, R.E.; Li, L.; Kochian, L.V. . Genetics. 2004, 167 (4): 1905–1914. PMC 1471010
 . PMID 15342528. doi:10.1534/genetics.103.023580.
. PMID 15342528. doi:10.1534/genetics.103.023580. - . BBC. 22 June 2001. (原始内容存档于12 December 2013).
- Bosch, Xavier. . Nature. 27 June 2001: news010628–11. doi:10.1038/news010628-11. (原始内容存档于31 December 2010).
- Sheridan, J.E.; Nelson, Jan; Tan, Y.L. . Tuatara: 29. (原始内容存档于13 December 2013).
- . Duncan Aviation. 2011. (原始内容存档于25 February 2015).
延伸阅读
- Davis, J. R. . ASM International. 1999. ISBN 978-1-61503-238-9 (英语).
- Dean, J. A. 15. McGraw-Hill. 1999. ISBN 978-0-07-016384-3. OCLC 40213725.
- Drozdov, A. . RUSAL Library. 2007. ISBN 978-5-91523-002-5.
- Greenwood, N. N.; Earnshaw, A. 2nd. Butterworth-Heinemann. 1997. ISBN 978-0-08-037941-8.
- King, R. B. . Wiley-VCH. 1995. ISBN 978-0-471-18602-1.
- Lide, D. R. (编).
 84. CRC Press. 2004. ISBN 978-0-8493-0566-5.
84. CRC Press. 2004. ISBN 978-0-8493-0566-5. - Nappi, C. (PDF) (报告). International Aluminium Institute. 2013. (原始内容存档 (PDF)于2022-10-09).
- Richards, J. W. 3. Henry Carey Baird & Co. 1896.
- Schmitz, C. . Vulkan-Verlag GmbH. 2006. ISBN 978-3-8027-2936-2 (英语).
外部链接
- 元素铝在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— 铝(英文)
- 元素铝在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素铝在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 铝(英文)
| 维基共享资源上的相关多媒体资源:铝 |
- Aluminum (页面存档备份,存于) at The Periodic Table of Videos (University of Nottingham)
- CDC - NIOSH Pocket Guide to Chemical Hazards - Aluminum (页面存档备份,存于)
- Electrolytic production
- World production of primary aluminum, by country (页面存档备份,存于)
- Price history of aluminum, according to the IMF (页面存档备份,存于)
- History of Aluminum (页面存档备份,存于) – from the website of the International Aluminum Institute
- Emedicine – Aluminum (页面存档备份,存于)
- 短片 ALUMINUM (1941) 可在互联网档案馆自由下载